- Im Vordergrund der Behandlung der akuten myeloischen Leukämie (AML) steht die intensive Chemotherapie: Sie soll die Leukämiezellen komplett zerstören und dadurch die normale, gesunde Blutbildung wiederherstellen.
- Für manche Patienten kommt auch eine Blutstammzelltransplantation in Betracht – andere zeigen in ihren Leukämiezellen besondere genetische Veränderungen und können zusätzlich mit einer zielgerichteten Therapie behandelt werden.
- Das bedeutet: Die "Standardbehandlung" bei der AML gibt es nicht. Welche Therapie die Ärzte einsetzen, hängt von der individuellen Erkrankungssituation der Patientin oder des Patienten ab.
Wichtig: Informationen aus dem Internet können Ihnen einen Überblick bieten. Sie sind aber nicht dazu geeignet, die Beratung durch einen Arzt oder eine Ärztin zu ersetzen.
Behandlung der AML: Wichtiges in Kürze
Zum Weiterlesen
Rasche Behandlung wichtig: Bei einer akuten myeloischen Leukämie (AML) breiten sich Leukämiezellen innerhalb weniger Wochen schnell im Knochenmark, im Blut und im ganzen Körper aus. Im Knochenmark werden immer weniger normale Blutzellen gebildet und betroffene Organe sind in ihrer Funktion beeinträchtigt. Die Folge: In kurzer Zeit kommt es zu bedrohlichen Beschwerden. Die Patientinnen und Patienten sind akut gefährdet.
Ziel der Behandlung ist möglichst die Heilung: Die Therapie soll die Leukämiezellen komplett vernichten und die normale Blutbildung wiederherstellen.
Im Zentrum der Behandlung steht bei den meisten Patientinnen oder Patienten eine intensive Chemotherapie. Haben Betroffene bestimmte genetische Veränderung in den AML-Zellen, setzen Ärzte gegebenenfalls zusätzlich zur Chemotherapie zielgerichtete Medikamente ein. Für einige Patienten kommt im Rahmen der Erstbehandlung auch eine Hochdosis-Chemotherapie mit anschließender Blutstammzelltransplantation infrage.
Die AML-Therapie verläuft in verschiedenen Phasen:
- Die Vortherapie soll die Induktionstherapie möglichst schonend einleiten. Sie ist nicht bei allen Patienten notwendig.
- Die Induktionstherapie soll die Leukämiezellen möglichst rasch zurückdrängen.
- Die Konsolidierungs- und Erhaltungstherapie soll noch verbliebene bösartige Blutzellen im Körper abtöten und den Therapieerfolg langfristig sichern.
Eine Standardbehandlung gibt es nicht: Trotz Fortschritten bei der AML-Therapie gibt es bisher keine Therapie, die für alle Betroffenen gleich gut geeignet ist. Die Art der Behandlung, das Therapieschema, die Dosierung und der Therapieablauf können sich von Patient zu Patient unterscheiden. Eine Rolle spielt hier vor allem, an welcher AML-Unterform man erkrankt ist und wie hoch die Ärzte das persönliche Rückfallrisiko einschätzen.
Unterstützende Begleitbehandlungen sind für jeden Betroffenen mit einer akuten myeloischen Leukämie ein wichtiger Bestandteil der Behandlung: Sie vermeiden oder lindern die Beschwerden durch die Leukämie sowie die Nebenwirkungen der Tumortherapie und verbessern die Lebensqualität.
Chemotherapie bei einer AML: Ablauf

Bild: © Krebsinformationsdienst, DKFZ; Foto: Tobias Schwerdt
Hauptbestandteil der AML-Behandlung ist eine Chemotherapie mit sogenannten Zytostatika. Sie hindern Zellen daran, sich zu vermehren und bringen sie zum Absterben.
Die "Chemo" wirkt im gesamten Körper und besonders gut gegen sich schnell teilende Zellen. Zu diesen gehören die Leukämiezellen bei der AML, aber auch etliche Zellen in gesunden Geweben. Deshalb müssen Betroffene mit Nebenwirkungen rechnen und sie benötigen entsprechende unterstützende Behandlungsmaßnahmen.
Welche Medikamente werden eingesetzt?
Bei der akuten myeloischen Leukämie reicht ein einzelnes Medikament in der Regel nicht aus, um alle Leukämiezellen zu zerstören. Deshalb kombinieren Ärzte verschiedene Zytostatika. Durch die unterschiedlichen Angriffspunkte der Medikamente auf die Leukämiezellen wird die Therapie insgesamt wirksamer.
Ein wichtiges Medikament ist Cytarabin (ARA-C), ein sogenannter Antimetabolit. Daneben setzen Ärzte wachstumshemmende (zytostatisch wirkende) Antibiotika ein, etwa Anthrazykline oder Mitoxantron. Gegebenenfalls kommen weitere Zytostatika in Betracht.
Kombination mit zielgerichteter Therapie: Bei manchen Patientinnen oder Patienten stellen Ärzte bei den molekulargenetischen Voruntersuchungen fest, dass die Leukämiezellen eine bestimmte genetische Veränderung tragen: Sie haben eine sogenannte FLT3-Mutation. Dann kombinieren Ärzte die Chemotherapie mit dem zielgerichteten Medikament Midostaurin. Darüber hinaus profitieren Patienten mit einer sogenannte CD33-positiven AML und zusätzlichen günstigen genetischen Veränderungen von einer zusätzlichen zielgerichteten Therapie mit dem Antikörper Gemtuzumab-Ozogamicin.
Wie werden die Medikamente verabreicht?

Bild: © KatarzynaBialasiewicz, Thinkstock
Alle Patientinnen und Patienten, die eine AML-Therapie erhalten, benötigen in der Regel einen zentralen Venenzugang (ZVK, Port).
- Informationen zu Ports finden Sie in unserem Text Port zur Chemotherapie: Wie pflegen, wann entfernen?
Über den Port erhält man die Zytostatika-Infusionen oder -spritzen. Seltener gibt es Medikamente in Tablettenform.
Die Chemotherapie erfolgt in mehreren Phasen, auch "Zyklen" genannt. Zwischen den einzelnen Behandlungsphasen liegen Behandlungspausen: Sie geben dem Körper und den gesunden Zellen die Möglichkeit, sich zu erholen.
- Gut zu wissen: Bei der Induktionstherapie erhalten Patientinnen und Patienten häufig nur einen einzelnen Zyklus.
Erste Behandlungsphase: Induktionstherapie der AML

Bild: © Rido, Shutterstock
In der Regel erhalten Patientinnen und Patienten mit einer akuten myeloischen Leukämie (AML) zu Beginn eine Chemotherapie – in der Regel 1 Zyklus, manchmal auch 2. Diese erste Therapiephase bezeichnen Fachleute auch als "Induktions-Chemotherapie". Für Patienten, die aufgrund ihres Alters oder ihrer Begleiterkrankungen keine Chemotherapie erhalten können, kommen gegebenenfalls auch andere Medikamente infrage.
Schneller Therapiebeginn: Nachdem die Ärzte die Diagnose der AML gesichert haben, beginnen sie baldmöglichst mit der Induktionschemotherapie.
- Bei den meisten Patientinnen und Patienten ist es vertretbar, den Therapiebeginn um einige wenige Tage zu verzögern: etwa dann, wenn noch Ergebnisse einer genetischen Untersuchung der Leukämiezellen ausstehen.
- Sofort behandelt werden Patienten mit lebensbedrohlichen Beschwerden oder einem raschen Fortschreiten der Leukämie.
Was soll die Therapie erreichen? Ziel der Induktionstherapie ist es, eine komplette Remission zu erreichen: Das bedeutet, die Chemotherapie-Medikamente haben die Leukämiezellen zurückgedrängt und die gesunde Blutbildung ist wiederhergestellt.
- Wichtig: Eine komplette Remission ist keine Heilung. Diese kann erst nach Abschluss der Konsolidierungstherapie erreicht werden.
Vortherapie: Nicht bei allen AML-Patienten notwendig
Haben Betroffene eine sehr hohe Anzahl von Leukämiezellen im Blut, erhalten sie vor der Induktionstherapie eine Vortherapie.
Gut zu wissen
Von einer "sehr hohen Zahl" an Leukämiezellen sprechen Fachleute bei über 50.000 Leukozyten pro Mikroliter Blut.
Bei der Vortherapie handelt es sich um eine Chemotherapie, die höchstens eine Woche dauert. Dazu erhalten Patientinnen und Patienten üblicherweise 1 oder 2 Zytostatika, zum Beispiel Cytarabin oder Hydroxyharnstoff.
Was soll die Therapie erreichen? Die Vortherapie soll die Anzahl der Leukämiezellen stufenweise und möglichst schonend verringern. Dafür steigern Ärzte die Behandlungsintensität vorsichtig. Ziel des stufenweisen Vorgehens:
- Ärztinnen und Ärzte wollen gefährliche Komplikationen wie Blutungen oder Störungen der Blutgerinnung vermeiden.
- Und sie wollen ein sogenanntes Zellzerfall- oder Tumorlyse-Syndrom verhindern: Wenn der Körper abgetötete Zellen abbaut, entstehen Stoffwechselprodukte – gewissermaßen "Zellschrott". Dieser kann in großen Mengen die Nieren schädigen. Die Gefahr einer solchen Komplikation ist umso größer, je höher die anfängliche Leukämiezellzahl ist und je schneller die Chemotherapie die bösartigen Zellen zerstört.
Medikamente der Induktionstherapie
Welche Medikamente die Ärzte für die Induktionstherapie wählen, wie hoch sie die Medikamente dosieren und in wie vielen Zyklen sie diese verabreichen, ist unterschiedlich.
Eine Rolle spielen
- das Alter des Patienten oder der Patientin,
- Begleiterkrankungen sowie
- das zu erwartenden Rückfallrisiko.
Für die Induktionstherapie erhalten viele Patientinnen und Patienten eine Kombination aus dem Chemotherapeutikum Cytarabin und Daunorubicin, Idarubicin oder Mitoxantron. Daneben gibt es auch andere Chemotherapie-Schemata, die Ärzte bei der Induktionstherapie der AML anwenden. Manchmal profitieren Patienten auch von dem Medikament CPX-351, insbesondere, wenn sich die AML nach einer zuvor durchgeführten Krebsbehandlung entwickelt hat. CPX-351 kombiniert die Chemotherapeutika Cytarabin und Daunorubicin in einem Präparat.
Induktionstherapie auch ambulant möglich?

Bild: © Ground Picture, Shutterstock
Normalerweise nicht, denn die Induktionstherapie bei der akuten myeloischen Leukämie (AML) ist eine anstrengende und intensive Behandlung.
Die Patientinnen und Patienten neigen zu Infekten, bis sich die Blutbildung erholt hat. Sie benötigen daher eine engmaschige Überwachung und verschiedene unterstützende therapeutische Maßnahmen – etwa Blutprodukte oder Antibiotika. Zudem müssen Pflegekräfte und Ärzte die Betroffenen engmaschig überwachen.
Daher bleiben die meisten AML-Patienten während der Induktionstherapie im Krankenhaus.
Zweite Behandlungsphase: Konsolidierungstherapie der AML
Nach der Induktionstherapie schließt sich für Patientinnen und Patienten mit einer akuten myeloischen Leukämie (AML) eine sogenannte Konsolidierungstherapie an.
Voraussetzung: Damit Ärzte mit der Konsolidierungstherapie starten können, muss es bei dem Patienten unter der Induktionstherapie zu einer kompletten Remission gekommen sein. Das bedeutet: Das Blutbild hat sich normalisiert und im Knochenmark sind nur noch wenige Leukämiezellen nachweisbar.
Was soll die Therapie erreichen? Die komplette Remission durch die Induktionstherapie ist nicht mit Heilung gleichzusetzen. Vereinzelt noch im Körper verbliebene Leukämiezellen können immer zu einem Rückfall führen. Die Konsolidierungstherapie soll noch verbliebene Leukämiezellen zerstören und somit eine dauerhafte Heilung sichern.
Wann beginnt die Therapie? Normalerweise beginnt die Konsolidierungstherapie direkt im Anschluss an die Induktionstherapie. Für einen optimalen Therapieverlauf ist es wichtig, dass das Zeitfenster zwischen den beiden Behandlungsphasen möglichst klein ist.
Möglichkeiten der Konsolidierungstherapie
Welche Konsolidierungstherapie die behandelnden Ärzte wählen, wie sie diese dosieren und welche Behandlungen sie kombinieren, orientiert sich an verschiedenen Faktoren: Dazu zählen das Alter sowie mögliche Begleiterkrankungen. Auch das persönliche Rückfallrisiko oder genetische Merkmale spielen eine Rolle.
In Betracht kommen
- eine intensive Chemotherapie oder
- eine Kombination aus Hochdosis-Chemotherapie und einer Transplantation fremder (allogener) Blutstammzellen.
Intensive Chemotherapie
Eine intensive Chemotherapie zur Konsolidierung umfasst, je nach individueller Situation, ein bis drei Therapiezyklen. Ärzte setzen hierfür in der Regel das Zytostatikum Cytarabin ein. Hat der Patient bereits bei der einleitenden Induktions-Chemotherapie zusätzlich das zielgerichtete Medikament Midostaurin erhalten? Dann führen die Ärzte diese Kombinationstherapie gegebenenfalls in der Konsolidierungsphase fort.
Hochdosistherapie mit nachfolgender Stammzelltransplantation
Zum Weiterlesen
Eine frühzeitige Transplantation fremder Blutstammzellen (allogene Blutstammzelltransplantation als Konsolidierungstherapie kann die Wahrscheinlichkeit für einen Rückfall senken und zu einer Heilung führen. Je höher die Ärzte das Risiko für einen Rückfall einschätzen, desto eher können Patienten von einer solchen Transplantation profitieren.
Bei jedem machbar? Prinzipiell ja. Heute finden Onkologen praktisch für jede Patientin oder jeden Patienten mit einer akuten myeloischen Leukämie einen Spender oder eine Spenderin. Zudem haben Ärzte inzwischen die Möglichkeit, die Stärke der Hochdosistherapie vor der Transplantation anzupassen. Das macht eine allogene Transplantation auch bei vielen älteren Patienten möglich.
Aber: Trotzdem erhalten am Ende nur wenige Patientinnen und Patienten mit einer AML eine allogene Transplantation. Gründe sind neben einer körperlichen Gebrechlichkeit und Begleiterkrankungen auch krankheitsbezogene Faktoren: Bei einigen Patienten spricht die Erkrankung auf die erste Chemotherapie nicht an und sie schreitet voran, bevor die Ärzte eine Transplantation durchführen können.
Nutzen-Risiko-Abwägung: Die Entscheidung für oder gegen eine Transplantation treffen die behandelnden Ärzte gemeinsam mit dem Patienten und Angehörigen immer individuell: Dabei wägen sie alle Vorteile gegen mögliche Nachteile ab.
Möglichkeiten der Erhaltungstherapie
Für manche Patientinnen und Patienten mit einer akuten myeloischen Leukämie (AML) kann nach einer intensiven Konsolidierungstherapie eine Erhaltungstherapie in Betracht kommen. Ärztinnen und Ärzte setzen hierfür beispielsweise das Medikament Azacitidin oder zielgerichtete Medikamente ein. Eine Voraussetzung ist, dass die Betroffenen in Remission sind.
Ziel der Erhaltungstherapie: Die nach der Remission verbliebenen Leukämiezellen über einen langen Zeitraum hinweg zu bekämpfen, zu zerstören und dadurch einen Rückfall zu verhindern.
Für wen kommt eine Erhaltungstherapie infrage? Eine Erhaltungstherapie eignet sich für manche Patientinnen und Patienten, die keine Stammzelltransplantation erhalten haben. Manchmal ist auch nach einer Stammzelltransplantation eine Erhaltungstherapie möglich.
AML-Rezidiv: Behandlung bei einem Rückfall
In den letzten Jahrzehnten haben sich die Behandlungsergebnisse für Patientinnen und Patienten mit einer akuten myeloischen Leukämie (AML) verbessert. Dennoch kehrt die AML bei vielen Betroffenen nach einer Erstbehandlung wieder zurück (Rezidiv).
Die Wahrscheinlichkeit für einen Rückfall ist in den ersten zwei Jahren nach der Erstbehandlung am höchsten. Bei einigen Patienten spricht die Leukämie auch von vornherein nicht oder nur unzureichend auf die Behandlung an.
Wie erfolgreich die Behandlung die Erkrankung ein zweites Mal dauerhaft zurückdrängen kann, ist von verschiedenen Faktoren abhängig:
- Alter und der Gesundheitszustand der Patientin oder des Patienten
- die Art der Vorbehandlung
- die Aggressivität der Leukämie
- Zeitpunkt des Rezidivs: Je früher ein Rückfall auftritt, desto schwerer ist er zu behandeln.
Behandlungsmöglichkeiten bei einem Rezidiv
Bei einem Rückfall mit einer akuten myeloischen Leukämie (AML) gibt es keine "Standardtherapie". Patientinnen und Patienten mit einem Rezidiv der AML stehen verschiedene therapeutische Möglichkeiten offen, je nachdem wie die individuellen Voraussetzungen sind.
Intensive Chemotherapie mit anschließender Transplantation fremder Blutstammzellen: Die Therapie verläuft ähnlich wie die Ersttherapie. Manche Patientinnen und Patienten erhalten zunächst eine sogenannte Re-Induktionstherapie, also eine intensive Chemotherapie zur Vorbereitung.
Therapie individuell klären
Eine Induktions-Chemotherapie ist nicht bei allen Patientinnen und Patienten erforderlich – manchmal starten die Ärzte auch direkt die Hochdosis-Chemotherapie.
Daran schließt sich eine Konsolidierung an, beginnend mit einer Hochdosis-Chemotherapie. Dann werden der Patientin oder dem Patienten fremde Blutstammzellen transplantiert (allogene Stammzelltransplantation). Das Ziel bei dieser Therapie ist wie in der Erstbehandlung die Heilung.
Weniger intensive Chemotherapie: Es kann sein, dass eine intensive Rezidiv-Therapie für den einzelnen Patienten nicht infrage kommt. Etwa weil es der Allgemeinzustand des Betroffenen nicht zulässt. Dann besteht die Möglichkeit, zielgerichtete Medikamente in Kombination mit Azacitidin einzusetzen. Alternativ kann auch eine niedrig dosierte Chemotherapie infrage kommen. Hier steht im Vordergrund, die Erkrankung möglichst lange zurückzudrängen und trotzdem eine akzeptable Lebensqualität zu erhalten.
An einer klinischen Studie teilzunehmen, ist für Patientinnen und Patienten mit einem Rückfall der akuten myeloischen Leukämie ebenfalls eine Möglichkeit: Forscherinnen und Forscher untersuchen für die AML eine Vielzahl an neuartigen Therapieansätzen.
Spricht die AML auf keine Therapie gegen Leukämiezellen mehr an, erhalten Betroffene eine bestmögliche unterstützende Therapie: Ärztinnen und Ärzte sorgen dann vor allem dafür, Schmerzen dauerhaft zu behandeln und die Patientin oder den Patienten unterstützend zu begleiten.
Sonderform: Akute Promyelozytenleukämie (APL)
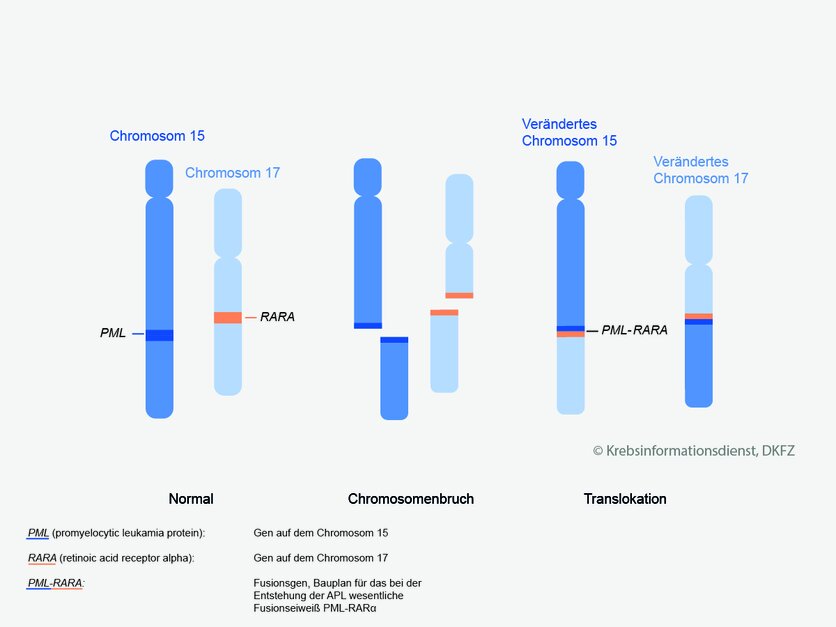
Bild: © Krebsinformationsdienst, DKFZ; Grafik: Asena Tunali
Die akute Promyelozytenleukämie (APL) ist eine seltene Unterform der akuten myeloischen Leukämie (AML).
Besonderheiten: Die Leukämiezellen haben bei der APL unter dem Mikroskop eine besondere Form. Außerdem ist die Erbsubstanz der Leukämiezellen verändert: Zwei Abschnitte der Chromosomen 15 und 17 tauschen ihren Platz. Fachleute nennen dies eine Translokation.
Symptome einer akuten Promyelozytenleukämie
Blutungen besonders problematisch: Bei vielen Patienten mit einer akuten Promyelozytenleukämie (APL) ist die Blutgerinnung gestört. Ist auch die Zahl der Blutplättchen gering, nimmt bei Betroffenen die Blutungsneigung rasch zu und kann lebensbedrohlich werden.
Typische Beschwerden einer akuten Leukämie: Zusätzlich können Beschwerden durch den Mangel an roten und weißen Blutzellen entstehen. Charakteristisch sind dabei Müdigkeit, Leistungsabfall, Blässe sowie eine Infektanfälligkeit.
Symptome umgehend abklären: Treten erste Beschwerden auf, ist für die Betroffenen eine schnelle und gezielte Diagnostik besonders wichtig: Liegt eine APL vor, müssen Ärzte mit der Behandlung umgehend beginnen, um schwerwiegende Blutungskomplikationen zu verhindern.
Behandlung der akuten Promyelozytenleukämie
Die meisten Betroffenen mit einer akuten Promyelozytenleukämie (APL) haben sehr gute Heilungschancen. Für die APL stehen andere Behandlungsmöglichkeiten als für die akute myeloische Leukämie (AML) zur Verfügung.
Sehr gute Behandlungserfolge erzielen Ärzte durch Vitamin-A-Säure in Kombination mit einer Chemotherapie. Die Leukämiezellen reifen unter dieser Behandlung zu normalen weißen Blutkörperchen aus. Auch Arsenverbindungen sind bei der akuten Promyelozytenleukämie gut wirksam.
Chemotherapiefreie Behandlung möglich: Schätzen Ärzte das Rückfallrisiko der Patientin oder des Patienten gering ein, dann geht es auch ohne Chemotherapie. Die deutsche Fachgesellschaft empfiehlt dann, in der Erstbehandlung Arsentrioxid mit Vitamin A-Säure zu kombinieren.
Fragen Sie uns!
Möchten Sie mehr über die Diagnostik oder Behandlung der akuten Promyelozytenleukämie wissen? Gerne stehen unsere Ärztinnen und Ärzte Ihnen kostenfrei mit zusätzlichen Hintergrundinformationen zur Verfügung: am Telefon täglich von 8:00 bis 20:00 Uhr, unter 0800 – 420 30 40, per E-Mail an krebsinformationsdienst@dkfz.de oder über ein datensicheres Kontaktformular.
Therapie-Nebenwirkungen bei akuten Leukämien

Bild: © Jupiterimages, Thinkstock
Im Zentrum der Behandlung einer akuten myeloischen Leukämie (AML) steht die Chemotherapie.
Leider beeinträchtigt die Chemotherapie auch gesunde Zellen, die sich schnell teilen: Dazu zählen beispielsweise die blutbildenden Zellen im Knochenmark und die Zellen der Haarwurzeln sowie der Schleimhaut des Magen-Darm-Traktes. Das führt zu den typischen Nebenwirkungen einer Chemotherapie, etwa:
- Müdigkeit und Schwäche
- Übelkeit und Erbrechen
- Entzündungen und Reizungen der Schleimhäute
- gestörte Blutgerinnung
- Haarausfall
- Risiko von Infektionen
- Nervenmissempfindungen ("Kribbeln, Ameisenlaufen")
Viele dieser Beschwerden lassen sich behandeln oder klingen nach Abschluss der Therapie wieder ab.
Zum Weiterlesen
- Mehr zu Nebenwirkungen einer Chemotherapie und wie man sie lindern kann, finden Sie auf der Seite Chemotherapie-Medikamente: Wirkstoffe und Nebenwirkungen.
- Ist bei Ihnen auch eine Stammzelltransplantation geplant? Dann informiert der Text Transplantation von Blutstammzellen zu Nebenwirkungen und Risiken für Empfänger von Blutstammzellen.
Langzeitnebenwirkungen bei akuten Leukämien

Bild: © Jacek Chabraszewski, Thinkstock
Nach einer Chemotherapie kann es zu therapiebedingten Spätfolgen und Langzeitnebenwirkungen kommen. Insgesamt ist aber nur ein geringer Teil der Patientinnen und Patienten davon betroffen.
- Regelmäßige Arztbesuche können helfen, mögliche Spätfolgen der Erkrankung und Therapie zu entdecken und zu behandeln.
Zweitkrebs: Auf lange Sicht kann eine Chemotherapie die Wahrscheinlichkeit erhöhen, an einem anderen Krebs zu erkranken. Insbesondere für Patienten nach einer Hochdosis-Chemotherapie mit Stammzelltransplantation besteht ein erhöhtes Risiko für eine Zweittumorerkrankung des blutbildenden Systems oder für einen Tumor in einer anderen Körperregion.
Um eine Zweittumorerkrankung rechtzeitig zu erkennen, sollten Betroffene regelmäßig an Früherkennungsuntersuchungen teilnehmen und die jährliche Nachsorge in Anspruch nehmen.
Herzmuskelschwäche ist eine Langzeitnebenwirkung, die vor allem nach einer Chemotherapie mit sogenannten Anthrazyklinen beobachtet wird. Aus diesem Grund überwachen Ärzte schon vor und während einer Chemotherapie die Herzfunktion. Aber auch nach Abschluss der Behandlung empfehlen Experten, das Herz und seine Funktionen im Rahmen der Nachsorge regelmäßig untersuchen zu lassen.
Schädigung der Fruchtbarkeit: Eine akute Leukämie kann auch in jungen Jahren auftreten, wenn die Familienplanung noch nicht abgeschlossen ist. Für betroffene Patientinnen und Patienten gibt es Möglichkeiten, vorbeugende Maßnahmen zu treffen.
Trauer, Angst, Sorge: Einige Leukämiepatientinnen und Leukämiepatienten leiden unter Ängsten, Trauer oder haben andere psychische Belastungen. Manchmal kann sich daraus auch eine Depression entwickeln. Dann stehen ihnen verschiedene Unterstützungsmöglichkeiten zur Verfügung.
- Psychologische Unterstützung bei der Krankheitsverarbeitung
- Vom Umgang mit Angst: Die Zukunft zulassen
Fatigue: Auch unter einer chronischen Erschöpfung, der sogenannten Fatigue, leiden Leukämiepatientinnen und -patienten in Einzelfällen noch Jahre über die Behandlungszeit hinaus. Ärzte können eine Fatigue bislang leider nicht spezifisch behandeln. Trotzdem gibt für Betroffene Möglichkeiten, selbst etwas gegen die Fatigue zu tun.
- Weitere Informationen finden Sie in dem Text Fatigue bei Krebspatienten: Was tun bei Müdigkeit und Erschöpfung?
Detailwissen: Therapie bei FLT3-Mutation
Zum Weiterlesen
Zielgerichtete Krebstherapie: Das Tumorwachstum punktgenau hemmen
Informationsblätter zum Laden und Ausdrucken:
Zielgerichtete Krebstherapien: Wie funktionieren sie? (PDF)
Neue Krebstherapien: Zielgerichtete Therapie, Immuntherapie, Virotherapie (PDF)
Bei etwa einem Drittel der Patientinnen oder Patienten mit einer akuten myeloischen Leukämie (AML) zeigt sich in der molekulargenetischen Untersuchung eine besondere genetische Veränderung in ihren Krebszellen: eine sogenannte FLT3-Mutation.
FLT3 ist ein Eiweißmolekül, das Signale von der Oberfläche der Blutzelle ins Zellinnere weiterleitet. Fachleute bezeichnen Eiweiße dieser Art auch als Tyrosinkinasen. Die Tyrosinkinase FLT3 ist notwendig, damit sich Blutzellen normal entwickeln. Ist das Gen, das FLT3 herstellt, verändert ("mutiert"), dann ist die Tyrosinkinase dauerhaft aktiv: Die Blutzellen beginnen, sich unkontrolliert zu vermehren.
Ansatzpunkt für zielgerichtete Therapien: Midostaurin und Gilteritinib
Forscher haben Hemmstoffe entwickelt, die dauerhaft aktive Tyrosinkinasen wie FLT3 blockieren: sogenannte Tyrosinkinasehemmer (TKI). Erste FLT3-Hemmer hat die europäische Arzneimittelbehörde bereits zugelassen: Midostaurin und Gilterinib. Zeigen Patienten eine FLT3-Mutation, können Ärzte bei ihnen diese FLT3-Hemmer einsetzen:
Midostaurin setzen Ärzte in der Induktionstherapie und oft auch in der Konsolidierungstherapie zusätzlich zur Chemotherapie ein. Es hemmt neben FLT3 noch viele andere Tyrosinkinasen. Patienten können Midostaurin als Tablette schlucken.
- In klinischen Studien hat sich gezeigt: Junge Patientinnen und Patienten (< 60 Jahre) mit einer akuten myeloischen Leukämie und einer FLT3-Mutation leben länger, wenn sie zusätzlich zur Chemotherapie Midostaurin erhalten.
Gilterinib steht Patienten zur Verfügung, wenn die AML auf die Erstbehandlung nicht anspricht oder die Betroffenen einen Rückfall erlitten haben.
- In klinischen Studien hat sich gezeigt: Patienten mit einer FLT3-Mutation und einem Rückfall (Rezidiv) leben mit Gilterinib länger als mit einer alleinigen Chemotherapie.
Und es wird weiter geforscht
Forscher beschäftigen sich weiterhin intensiv mit der akuten myeloischen Leukämie (AML). Neben der zielgerichteten Therapie verfolgen die Wissenschaftler dabei auch andere Therapiearten zur Behandlung der AML:
- Immuntherapien mit Immun-Checkpoint-Hemmern oder eine Gentherapie mit sogenannten CAR-T-Zellen gelten bei der AML noch als experimentell. Das bedeutet, bisher kann man sich mit diesen Therapien nur im Rahmen von Studien behandeln lassen.
Fragen Sie uns!
Sie wollen sich zu neuen Behandlungsmethoden bei der akuten myeloischen Leukämie informieren? Gerne stehen unsere Ärztinnen und Ärzte Ihnen kostenfrei mit Hintergrundinformationen zur Verfügung:
- telefonisch täglich von 8:00 bis 20:00 Uhr unter 0800 – 420 30 40
- per E-Mail an krebsinformationsdienst@dkfz.de oder über ein datensicheres Kontaktformular
Quellen und Links für Interessierte und Fachkreise
Im Folgenden finden Sie eine Auswahl an hilfreichen Links zum Weiterlesen und Quellen, die für die Erstellung dieses Textes genutzt wurden.
Leitlinien
Deutsche Gesellschaft für Hämatologie und Onkologie (DGHO): Die DGHO bietet umfangreiche Informationen über den aktuellen Forschungsstand zu Leukämien. Ein besonderes Angebot ist die Leitlinien-Webseite der DGHO. Hier finden sich
- eine Leitlinie für die akute myeloische Leukämie und
- eine Leitlinie für die akute promyelozytären Leukämie (APL)
European Society for Medical Oncology (ESMO): Fey MF, Buske C; ESMO Guidelines Working Group. Acute myeloblastic leukaemias in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013 Oct;24 Suppl 6:vi138-43. doi: 10.1093/annonc/mdt320.
Systematische Reviews
Mao C, Fu XH, Yuan JQ, Yang ZY, Huang YF, Ye QL, Wu XY, Hu XF, Zhai ZM, Tang JL. Interleukin-2 as maintenance therapy for children and adults with acute myeloid leukaemia in first complete remission. Cochrane Database Syst Rev. 2015 Nov 6;(11):CD010248. doi: 10.1002/14651858.CD010248.pub2.
Fachartikel (Auswahl)
Boddu P, Kantarjian H, Garcia-Manero G, Allison J, Sharma P, Daver N. The emerging role of immune checkpoint based approaches in AML and MDS. Leuk Lymphoma. 2018 Apr;59(4):790-802. doi: 10.1080/10428194.2017.1344905.
Büchner T, Schlenk RF, Schaich M, Döhner K, Krahl R, Krauter J, Heil G, Krug U, Sauerland MC, Heinecke A et al. Acute Myeloid Leukemia (AML): different treatment strategies versus a common standard arm--combined prospective analysis by the German AML Intergroup. J Clin Oncol. 2012 Oct 10;30(29):3604-10. doi: 10.1200/JCO.2012.42.2907.
Cortes JE, Khaled S, Martinelli G, Perl AE, Ganguly S, Russell N, Krämer A, Dombret H, Hogge D, Jonas BA et al. Quizartinib versus salvage chemotherapy in relapsed or refractory FLT3-ITD acute myeloid leukaemia (QuANTUM-R): a multicentre, randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2019 Jul;20(7):984-997. doi: 10.1016/S1470-2045(19)30150-0.
Döhner H, Estey E, Grimwade D, Amadori S, Appelbaum FR, Büchner T, Dombret H, Ebert BL, Fenaux P, Larson RA et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017 Jan 26;129(4):424-447. doi: 10.1182/blood-2016-08-733196.
Gallogly MM, Lazarus HM. Midostaurin: an emerging treatment for acute myeloid leukemia patients. J Blood Med. 2016 Apr 19;7:73-83. doi: 10.2147/JBM.S100283. eCollection 2016.
Krug U, Lübbert M, Büchner T. Maintenance therapy in acute myeloid leukemia revisited: will new agents rekindle an old interest? Curr Opin Hematol. 2010 Mar;17(2):85-90. doi: 10.1097/MOH.0b013e3283366bf4.
Mathew NR, Baumgartner F, Braun L, O'Sullivan D, Thomas S, Waterhouse M, Müller TA, Hanke K, Taromi S, Apostolova P et al. Sorafenib promotes graft-versus-leukemia activity in mice and humans through IL-15 production in FLT3-ITD-mutant leukemia cells. Nat Med. 2018 Mar;24(3):282-291. doi: 10.1038/nm.4484.
Mondesir J, Willekens C, Touat M, de Botton S. IDH1 and IDH2 mutations as novel therapeutic targets: current perspectives. J Blood Med. 2016 Sep 2;7:171-80. doi: 10.2147/JBM.S70716.
Perl AE, Martinelli G, Cortes JE, Neubauer A, Berman E, Paolini S, Montesinos P, Baer MR, Larson RA, Ustun C et al. Gilteritinib or Chemotherapy for Relapsed or Refractory FLT3-Mutated AML. N Engl J Med. 2019 Oct 31;381(18):1728-1740. doi: 10.1056/NEJMoa1902688.
Stone RM, Mandrekar SJ, Sanford BL, Laumann K, Geyer S, Bloomfield CD, Thiede C, Prior TW, Döhner K, Marcucci G et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med. 2017 Aug 3;377(5):454-464. doi: 10.1056/NEJMoa1614359.
Vaughn JE, Buckley SA, Walter RB. Outpatient care of patients with acute myeloid leukemia: Benefits, barriers, and future considerations. Leuk Res. 2016 Jun;45:53-8. doi: 10.1016/j.leukres.2016.03.011.