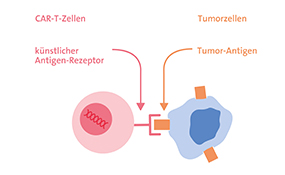
Neues aus den Studien
5-Jahres-Rückblick: Toxizität nach CD19-CAR-T-Zell-Therapie
In den Jahren 2013 – 2018 wurden unerwünschte Ereignisse von 636 Patienten, die im Zusammenhang mit Axicabtagen Ciloleucel oder Tisagenlecleucel auftraten, an die amerikanische Arzneimittelbehörde gemeldet (FAERS)7: Haupt-Toxizitäten mit Todesfolge waren ein Zytokin-Freisetzungs-Syndrom (CRS), hämatologische, kardiovaskuläre und neurologische Komplikationen sowie Infektionen. Insgesamt lag die nicht-rezidiv-bedingte Sterblichkeit bei 15 %.
Langzeit-Wirkung? Erste Langzeitdaten der zulassungsrelevanten Studien zeigen1,2,3: Auch 2 Jahre nach der Behandlung mit Tisagenlecleucel oder Axicabtagen Ciloleucel leben noch 40 – 60 % der Patienten ohne einen Rückfall. Axicabtagen Ciloleucel war auch für ältere Lymphompatienten über 65 Jahre mit Erfolg einsetzbar, ohne dass vermehrt Nebenwirkungen auftraten4. Von der Behandlung mit Tisagenlecleucel profitierten, einer Untergruppenauswertung zufolge, auch Patienten mit zytogenetischer Hochrisiko-B-Zell-Leukämie5.
Akut-Nebenwirkungen? Ein Zytokin-Freisetzungs-Syndrom (CRS) und neurologische Nebenwirkungen sind bekannte akute Nebenwirkungen einer CAR-T-Zell-Therapie. Erste 5-Jahres-Daten aus den USA zur Toxiziät sind in nebenstehender Infobox dargestellt. Heute kann die Toxizität durch eine engmaschige Diagnostik sowie eine Behandlung des CRS mit dem Anti-IL6-Antikörper Tocilizumab vermutlich deutlich vermindert werden.
Langzeit-Nebenwirkungen? Im Gegensatz zu den akuten Nebenwirkungen sind mögliche Langzeit-Toxizitäten bislang nicht ausreichend dokumentiert. Diskutiert wird vor allem eine anhaltende Beeinträchtigung des Immunsystems: Erste 2-Jahres-Daten für Axicabtagen Ciloleucel weisen darauf hin, dass bei 3 von 4 Patienten eine B-Zell-Aplasie und erniedrigte Immunglobuline verbleiben6. Seltener sind ausgeprägte Zytopenien und T-Zell-Defekte. Noch unklar ist beispielsweise, ob sich neurologische Toxizitäten auch langfristig auswirken, ob vermehrt Autoimmunerkrankungen auftreten und wie sich die Behandlung auf mögliche zukünftige Schwangerschaften auswirkt. Aufgrund der bislang fehlenden Langzeitdaten ist auch offen, ob das Risiko für Zweitumoren durch die CAR-T-Zell-Therapie erhöht wird.
Onkologische Zentren für CAR-T-Zell-Therapien
Qualitätsanforderungen an die CAR-T-Zell-Therapie
Herstellung: Sowohl für den Herstellungsprozess als auch für den Transport der CAR-T-Zellen gibt es streng vorgeschriebene Qualitätsstandards.
Durchführung: Die europäische Zulassungsbehörde (EMA) gibt klare Vorgaben für die Anwendung der CAR-T-Zell-Produkte10. Zudenm hat die Deutsche Gesellschaft für Hämatologie und Onkologie (DGHO) einen Kriterienkatalog für die Zertifizierung der Behandlungszentren erarbeitet11.
Nachsorge: Sowohl die europäische als auch die US-amerikanische Zulassungsbehörde fordern, die Daten aller mit CAR-T-Zellen behandelten Patienten produktübergreifend zu dokumentieren. In Europa gibt es dafür jetzt ein Register der European Society for Blood and Marrow Transplantation (EBMT)12.
Die Durchführung einer CAR-T-Zell-Therapie ist komplex und erfordert von der Indikationsstellung bis zur Nachsorge ein umfangreiches Qualitätsmanagement. Die Behandlung wird daher nur an wenigen, speziell zertifizierten Zentren angeboten.
Welche Zentren sind zertifiziert? Entsprechend den Qualitätsvorgaben der Zulassungsbehörden werden einzelne Zentren von den Herstellern für die Anwendung der CAR-T-Zell-Therapie geschult. Im Zentrum müssen ausgewiesene Kompetenzen vorhanden sein
- bei der Behandlung der Grunderkrankung,
- beim Umgang mit genmodifizierten Zellen und
- in der intensivmedizinischen Behandlung schwerwiegender Nebenwirkungen.
Derzeit sind etwa 15 deutsche Universitätskliniken für eine Behandlung mit Kymriah® und/oder Yescarta® qualifiziert. Eine offizielle Liste bereits zertifizierter Zentren gibt es bislang nicht. Ansprechpartner sind die behandelnden Onkologen beziehungsweise der Hersteller des entsprechenden CAR-T-Zell-Produkts.
CAR-T-Zell-Therapien in Studien? Neben den kommerziell erhältlichen CAR-T-Zell-Produkten werden in Deutschland auch klinische Studien mit neuen CAR-T-Zell-Konstrukten durchgeführt. Die genmodifizierten Zellen werden dafür meist mit einer besonderen Herstellungserlaubnis in den entsprechenden Studienzentren selbst hergestellt. In solchen Studien können Patienten behandelt werden, die aufgrund ihrer Erkrankungssituation kein kommerzielles CAR-T-Zell-Produkt erhalten können.
Erste Real-World-Erfahrungen mit CAR-T-Zellen
Erste Auswertungen amerikanischer Lymphompatienten, die außerhalb einer Studie mit Axicabtagen Ciloleucel behandelt wurden, zeigen8,9: Verglichen mit den Daten aus der entsprechenden Zulassungsstudie hatten die Patienten im Schnitt mehr Begleiterkrankungen und aggressivere Lymphome. Dennoch war die CAR-T-Zell-Therapie nicht toxischer. Das Ansprechen war vergleichbar, beziehungsweise nur geringfügig niedriger.
Auch in deutschen Zentren werden seit einigen Monaten Patienten mit Axicabtagen Ciloleucel oder Tisagenlecleucel behandelt. Die Herstellung der kommerziellen CAR-T-Zellen erfolgt derzeit noch in den USA. Europäische Produktions-Standorte sind jedoch in Planung. Erste deutsche Behandlungs-Daten stehen noch aus. Herstellerangaben zufolge käme die CD19-CAR-T-Zell-Therapie pro Jahr in Deutschland für etwa 50 Patienten mit akuter B-Zell-Leukämie sowie für etwa 500 – 1.000 Patienten mit aggressivem B-Zell-Lymphom infrage.
Therapiekosten – bisherige Erstattungsmodelle
Der von den pharmazeutischen Unternehmen für Deutschland aktuell veranschlagte Preis für Axicabtagen Ciloleucel beziehungsweise Tisagenlecleucel liegt bei ca. 320.000 Euro pro Behandlung.
Vertragsverhandlungen mit der GKV laufen: Während in anderen Ländern wie Großbritannien bereits eine Einigkeit über die CAR-T-Zell-Therapie im Rahmen der nationalen Versorgung erzielt werden konnte, laufen die Verhandlungen in Deutschland noch. Bislang muss von den Zentren in der Regel ein Einzelantrag auf Kostenübernahme durch die gesetzliche Krankenversicherung (GKV) gestellt werden.
Erste Rabattverträge als Zwischenlösung: Bis eine einheitliche Kostenübernahme für gesetzlich Versicherte vereinbart ist, haben sich einzelne Kassen mit den Herstellern auf ein neuartiges Bezahl-Modell geeinigt: Die beteiligten Kassen übernehmen die Kosten der Behandlung, erhalten jedoch einen Teil der Kosten vom Hersteller zurück, wenn die Therapie nicht den gewünschten Erfolg bringt.
Zukünftige Entwicklungen der CAR-T-Zell-Therapie
Die CAR-T-Zell-Therapie ist ein vielversprechender innovativer Therapieansatz in der Onkologie. Derzeit ist die CAR-T-Zell-Therapie aber nur für wenige Patienten mit bereits mehrfach vorbehandelten B-Zell-Leukämien und aggressiven B-Zell-Lymphomen etabliert. Akute Nebenwirkungen sind häufig und können lebensbedrohlich sein. Und: Nicht alle behandelten Patienten profitieren von der Therapie.
Breitere Anwendung? CD19-CAR-T-Zellen werden bei aggressiven B-Zell-Lymphomen bereits in der Erstlinie untersucht. Bei fortgeschrittenen indolenten B-Zell-Erkrankungen wie der chronisch lymphatischen Leukämie (CLL) oder dem follikulären Lymphom werden sie in Studien erprobt. Andere Krebsarten erfordern neue CAR-T-Zell-Konstrukte: Für das multiple Myelom gibt es erste Behandlungserfolge mit CAR-T-Zellen gegen das sogenannte B Cell Maturation Antigen (BCMA). Für solide Tumoren sind nach wie vor noch viele Fragen offen: Welche(s) Antigen(e) sind geeignet, wie gut kommen die CAR-T-Zellen in den Tumor und welche Rolle spielen die Zellen in der Tumorumgebung?
Bessere Wirksamkeit? Etliche Strategien werden diskutiert, um die Therapie mit CAR-T-Zellen sowohl bei bereits etablierten Indikationen als auch für neue Krebsarten effektiver zu machen und einer Resistenzentwicklung vorzubeugen:
- der Einsatz mehrerer CAR-T-Zell-Konstrukte mit unterschiedlichen Rezeptoren,
- die Kombination von CAR-T-Zellen mit anderen Immuntherapeutika sowie
- die Gabe von CAR-T-Zellen direkt in den Tumor.
Bessere Verträglichkeit? Veränderungen im Aufbau des chimären Rezeptors können das Risiko für ein schweres Zytokin-Freisetzungs-Syndrom möglicherweise verringern. Für B-Zell-Lymphome steht mit Lisocaptagen maraleucel bereits ein entsprechendes neues CD19-CAR-T-Zell-Produkt vor der Zulassung.
Zum Weiterlesen: Verwendete Quellen und vertiefende Informationen
Quellen
1 Locke FL, Ghobadi A, Jacobson CA, Miklos DB, Lekakis LJ, Oluwole OO, Lin Y, Braunschweig I, Hill BT, Timmerman JM et al. Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (ZUMA-1): a single-arm, multicentre, phase 1-2 trial. Lancet Oncol. 2019 Jan;20(1):31-42. doi: 10.1016/S1470-2045(18)30864-7.
2 Grupp SA, Maude SL, Rives S, Baruchel A, Boyer MW, Bittencourt H, Bader P, Büchner J, Laetsch TW, Stefanski H et al. Updated Analysis of the Efficacy and Safety of Tisagenlecleucel in Pediatric and Young Adult Patients with Relapsed/Refractory (r/r) Acute Lymphoblastic Leukemia. Blood 2018 132:895; doi: doi.org/10.1182/blood-2018-99-112599. Kongress-Abstract
3 Schuster SJ, Bishop MR, Tam C, Borchmann P, Jaeger U, Waller EK, Holte H, McGuirk JP, Jaglowski S, Tobinai K et al. Sustained disease control for adult patients with relapsed or refractory diffuse large B-Cell lymphoma: an updated analysis of Juliet, a global pivotal phase 2 trial of tisagenlecleucel. Blood 2018 132:1684; doi: doi.org/10.1182/blood-2018-99-115252. Kongress-Abstract
4 Neelapu SS, Jacobson CA, Oluwole OO, Munoz J, Deol A, Miklos DB, Bartlett NL, Braunschweig I, Jiang Y, Kim JJ et al. Outcomes of patients (pts) ≥ 65 years of age in ZUMA-1, a pivotal phase 1/2 study of axicabtagene ciloleucel (axi-cel) in refractory large B-cell lymphoma (LBCL). Journal of Clinical Oncology 2019 37:15_suppl, 7555-7555. Kongress-Abstract
5 Grupp S, Maude S, Baruchel A, Laetsch TW, Driscoll T, Qayed M, Levine J, Boyer M, Krueger J, Myers GD et al. Tisagenlecleucel appears effective and safe in pediatric and young adults with relapsed/refractory acute lymphoblastic leukemia with high risk cytogenetic abnormalities. EHA Library. A. Grupp S. Jun 16, 2019; 267372; S1618. Kongress-Abstract
6 Strati P, Adkins S, Nastoupil LJ, Westin J, Hagemeister FB, Fowler NH, Lee HJ, Fayad L, Samaniego F, Ahmed S et al. Hematopoietic recovery and immune reconstitution after axi-cel CAR T-cell therapy in patients with relapsed/refractory large B-cell lymphoma. Journal of Clinical Oncology 2019 37:15_suppl, 7545-7545. Kongress-Abstract
7 Anand K, Burns E, Sano D, Pingali SR, Westin J, Nastoupil LJ, Lee HJ, Samaniego F, Parmar S, Wang M, et al. Comprehensive report of anti-CD19 chimeric antigen receptor T cells (CAR-T) associated non-relapse mortality (CART-NRM) from FAERS. Journal of Clinical Oncology 2019 37:15_suppl, 2540-2540. Kongress-Abstract
8 Jacobson CA, Hunter B, Armand P, Kamihara Y, Ritz J, Rodig SJ, Wright K, Lipschitz M, Redd RA, Maus MV et al. Axicabtagene Ciloleucel in the Real World: Outcomes and Predictors of Response, Resistance and Toxicity. Blood 2018 132:92; doi: doi.org/10.1182/blood-2018-99-117199. Kongress-Abstract
9 Nastoupil LJ, Jain MD, Spiegel JY, Ghobadi A, Lin Y, Dahiya S, Lunning MA, Lekakis LJ, Reagan PM, Oluwole OO et al. Axicabtagene Ciloleucel (Axi-cel) CD19 Chimeric Antigen Receptor (CAR) T-Cell Therapy for Relapsed/Refractory Large B-Cell Lymphoma: Real World Experience. Blood 2018 132:91; doi: doi.org/10.1182/blood-2018-99-114152. Kongress-Abstract
Weitere Übersichtsarbeiten und Fachveröffentlichungen
Abramson J, Gordon LI, Palomba ML, Lunning MA, Arnason JE, Forero-Torres A, Wang M, Maloney DG, Sehgal A, Andreadis C et al. Updated safety and Long term clinical outcomes in TRANSCEND NHL 001, pivotal Trial of lisocabtagene maraleucel (JCAR017) in r/r aggressive NHL. J Clin Oncol. 2018; 36(suppl):7505 (abstract). doi: 10.1200/JCO.2018.36.15_suppl.7505.
Bair SM and Porter DL (2019). Accelerating chimeric antigen receptor therapy in chronic lymphocytic leukemia: The development and challenges of chimeric antigen receptor T-cell therapy for chronic lymphocytic leukemia. Am J Hematol. 2019 May;94(S1): S10-S17. doi: 10.1002/ajh.25457.
Chavez JC, Bachmeier C and Kharfan-Dabaja MA. CAR T-cell therapy for B-cell lymphomas: clinical trial results of available products. Ther Adv Hematol. 2019; 10: 2040620719841581. Published online 2019 Apr 15. doi: 0.1177/2040620719841581.
Hunter B and Jacobson C. Editorial: CAR T-Cell Associated Neurotoxicity: Mechanisms, Clinicopathologic Correlates, and Future Directions. JNCI J Natl Cancer Inst (2019) 111(7): djz017. doi: 10.1093/jnci/djz017.
Kansagra AJ et al. Clinical utilization of Chimeric Antigen Receptor T-cells (CAR-T) in B-cell acute lymphoblastic leukemia (ALL)-an expert opinion from the European Society for Blood and Marrow Transplantation (EBMT) and the American Society for Blood and Marrow Transplantation (ASBMT). Bone Marrow Transplant. 2019 May 15. doi: 10.1038/s41409-019-0451-2.
Lee DW, Santomasso BD, Locke FL, Ghobadi A, Turtle CJ, Brudno JN, Maus MV, Park JH, Mead E, Pavletic S et al. ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Effector Cells. Biol Blood Marrow Transplant. 2019 Apr;25(4):625-638. doi: 10.1016/j.bbmt.2018.12.758.
Metzinger MN, Verghese C, Hamouda DM, Lenhard A, Choucair K, Senzer N, Brunicardi FC, Dworkin L, Nemunaitis J. Chimeric Antigen Receptor T-Cell Therapy: Reach to Solid Tumor Experience. Oncology. 2019;97(2):59-74. doi: 10.1159/000500488.
Neelapu SS, Chavez JC, Lin Y, Munoz J, Ujjani CS, Riedell P, De Vos S, Oluwole OO, Kekre N, Yang Y et al. ZUMA-12: A phase 2 multicenter study of axicabtagene ciloleucel (axi-cel) as a first-line therapy in patients (pts) with high-risk large B-cell lymphoma (LBCL). J Clin Oncol 37, 2019 (suppl; abstr PS7574).
Subklewe M, von Bergwelt-Baildon M and Humpe A. Chimeric Antigen Receptor T Cells: A Race to Revolutionize Cancer Therapy. Transfus Med Hemother 2019; 46:15–24. doi.org/10.1159/000496870.
Tai YT and Anderson KC. B cell maturation antigen (BCMA)-based immunotherapy for multiple myeloma. Expert Opin Biol Ther. 2019 Jul 11:1-14. doi: 10.1080/14712598.2019.1641196.
Zheng PP, Kros JM and Li J. Approved CAR T cell therapies: ice bucket challenges on glaring safety risks and long-term impacts. Drug Discov Today. 2018 Jun;23(6):1175-1182. doi: 10.1016/j.drudis.2018.02.012.
Rechtlicher Rahmen/Behördeninformationen
10 European Medicines Agency (EMA):
Yescarta (EPAR, Produktbeschreibung) www.ema.europa.eu/en/medicines/human/EPAR/yescarta
www.ema.europa.eu/en/documents/product-information/yescarta-epar-product-information_de.pdf (PDF)
Kymriah (EPAR, Produktbeschreibung) www.ema.europa.eu/en/medicines/human/EPAR/kymriah
www.ema.europa.eu/en/documents/product-information/kymriah-epar-product-information_de.pdf (PDF)
11 DGHO, CAR-T-Zellen Strukturkriterien 2019; www.dgho.de/publikationen/stellungnahmen/gute-aerztliche-praxis/car-t-zelltherapie/car-t-zellen-strukturkriterien-20190313.pdf/@@download/file/CAR-T-Zellen%20Strukturkriterien%2020190313.pdf (PDF)
12 European Society for Blood and Marrow Transplantation (EBMT): www.ebmt.org/ebmt/news/registration-car-t-cell-therapies-ebmt-registry
G-BA – Beschlüsse:
Tisagenlecleucel DLBCL: www.g-ba.de/beschluesse/3700/
Tisagenlecleucel ALL: www.g-ba.de/beschluesse/3701/
Axicabtagen-Ciloleucel DLBCL: www.g-ba.de/beschluesse/3771/
Axicabtagen-Ciloleucel PMBCL: www.g-ba.de/beschluesse/3772/