Nimotuzumab: ein neuer Therapieansatz?
Nimotuzumab ist ein monoklonaler Antikörper gegen den epidermalen Wachstumsfaktor-Rezeptor (EGFR). Der EGFR-Hemmer hat in der Europäischen Union Orphan-Drug-Status, ist aber nicht als Arzneimittel zugelassen. In 30 Staaten in Asien, Afrika und Südamerika besteht eine Zulassung. Nimotuzumab wurde bereits in Studien als Monotherapie und in Kombination mit Gemcitabin bei Patienten mit fortgeschrittenen Pankreaskarzinomen untersucht. Das Medikament ist nur für Patienten mit KRAS-Wildtyp geeignet.
Nimotuzumab: Phase-III-Studie NOTABLE
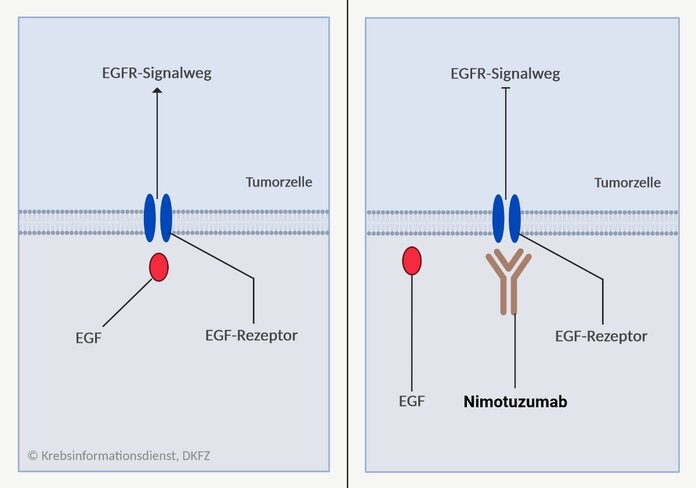
Bild: Krebsinformationsdienst, DKFZ, erstellt mit Biorender.com
Aktuelle Ergebnisse der doppelblinden, randomisierten Phase-III-Studie NOTABLE zeigen1: Bei 92 Teilnehmenden mit metastasiertem oder lokal fortgeschrittenem Pankreaskarzinom verbesserte die Hinzunahme des EGFR-Antikörpers Nimotuzumab zu Gemcitabin das Gesamtüberleben (OS) und das progressionsfreie Überleben (PFS) statistisch signifikant. Im Detail:
- OS: im Median 10,9 Monate mit Nimotuzumab (Nim) versus 8,5 Monate in der Kontrollgruppe (KG)
- 1-Jahres-Überlebensrate: 43,6 Prozent (Nim) versus 26,8 Prozent (KG)
- 3-Jahres-Überlebensrate: 13,9 Prozent (Nim) versus 2,7 Prozent (KG)
Voraussetzung für die Wirksamkeit von Nimotuzumab ist das Vorliegen eines KRAS-Wildtyps im Tumor. Nur dann kann das Medikament die Lebenszeit verlängern. Ob die Ergebnisse der NOTABLE-Studie ein Durchbruch sind oder nicht, wird unterschiedlich gewertet.
Nimotuzumab: Wirkweise bei KRAS-Wildtyp
Der monoklonale Antikörper Nimotuzumab blockiert EGF-Rezeptoren an der Zelloberfläche und verhindert so, dass Wachstumsfaktoren andocken. Liegt keine KRAS-Mutation (KRAS-Wildtyp) vor, kann dadurch der EGFR-Signalweg (auch MAP-Kinase-Signalweg) unterbrochen und das Wachstum der Tumorzellen gebremst werden. Tumoren mit KRAS-Wildtyp bieten damit einen potenziellen Angriffspunkt (Target) für Nimotuzumab.
Hintergrund zu EGFR, KRAS und Mutationen
RAS, KRAS
RAS ("rat sarcoma") steht für eine Proto-Onkogen-Familie, zu der auch KRAS (Kirsten Rat Sarcoma [virus]) gehört. Nach einer Mutation entsteht aus einem Proto-Onkogen ein krebsförderndes Onkogen. Mehr als 90 Prozent der duktalen Adenokarzinome des Pankreas, des häufigsten Subtyps, weisen eine Mutation im KRAS-Gen auf.
In Pankreaskarzinomzellen ist häufig – verursacht durch Ras-Proteine (kleine GTPasen) – der EGFR-Signalweg zu stark aktiviert. Ras-Proteine liegen in diesem Signalweg "unterhalb" von EGFR.
KRAS-Mutation: Ist das KRAS-Gen verändert, kann das resultierende Kras-Protein dauerhaft aktiv sein. Dann fördert es die Proliferation von Tumorzellen auch, wenn EGFR gehemmt ist. Das bedeutet, in diesem Fall kommt Nimotuzumab als Therapie nicht infrage. Es gibt aber Untertypen der KRAS-Mutation, gegen die es geeignete zielgerichtete Substanzen gibt (siehe weiter unten).
KRAS-Wildtyp: Nur wenige Pankreastumoren (5 bis 7 Prozent) sind nicht KRAS-mutiert. Für Patienten und Patientinnen mit KRAS-Wildtyp kann der neue EGFR-Hemmer Nimotuzumab eine Option sein. Zusätzliche Therapiemöglichkeiten kommen in Betracht, wenn weitere Genveränderungen – vor allem Fusionen – nachweisbar sind.
Häufigkeit von Gen-Veränderungen

Bild: Krebsinformationsdienst, DKFZ, erstellt mit Biorender.com
Wie häufig liegen überhaupt Genveränderungen vor, die "druggable" sind, also einer gezielten Behandlung zugänglich? Eine Orientierung darüber bietet eine "Real world genomic profiling"-Studie des US-amerikanischen National Cancer Institutes (NCI). Dafür hat das Forscherteam fast 17.000 Betroffene mit Pankreaskarzinom untersucht.
Am häufigsten fanden sich somatische Mutationen in folgenden Genen:
- KRAS (84,4 Prozent) als Haupt-Treiber-Gen
- TP53 (73,3 Prozent)
- CDKN2A (51,2 Prozent)
- CDKN2B (26,5 Prozent)
- SMAD4 (23,2 Prozent)
Als Target für zielgerichtete Ansätze eignen sich insgesamt aber eher wesentlich seltener vorkommende Genom-Alterationen. In dieser Kohorte waren dies beispielsweise:
- BRCA1 (1,4 Prozent)
- BRCA2 (3,6 Prozent)
- PIK3CA (3,3 Prozent)
- KRAS G12C (1,6 Prozent)
- BRAF (0,7 Prozent mit Fusionen)
Für die meisten Pankreaskarzinompatienten stehen derzeit keine evidenzbasierten Therapieoptionen aus der Präzisionsonkologie zur Verfügung.
Bei etwa 25 Prozent der Tumoren lassen sich zwar potenziell therapeutisch relevante Marker finden. Aber selbst im "Know Your Tumor"-Programm, in dem Patienten mit präzisionsonkologischen Methoden gezielt untersucht wurden, erhielten letztlich nur 2 Prozent tatsächlich eine entsprechende Therapie. Gründe dafür waren einerseits das aggressive Voranschreiten des Tumors, andererseits der mangelnde Zugang zu Medikamenten in der Off-Label-Anwendung.
Molekulardiagnostik: Basis für die Therapie?
Über Biomarker und Genveränderungen im Tumor als Grundlage einer präzisionsonkologischen Therapie wird noch diskutiert. Manche Experten befürworten eine frühe "Upfront"-Testung vor Behandlungsbeginn, andere eher einen späteren Einsatz nach Versagen der Erstlinientherapie. Auch, in welchem Umfang beim fortgeschrittenen Pankreaskarzinom getestet werden soll und inwieweit die Molekulardiagnostik derzeit nur in Studien sinnvoll ist, ist noch unklar.
Empfehlungen der S3-Leitlinie
In der S3-Leitlinie Pankreaskarzinom wird ausdrücklich Folgendes empfohlen:
- Vor Behandlung mit Immun-Checkpoint-Hemmern müssen Ärzte und Ärztinnen einen Defekt in einem DNA-Reparatursystem (dMMR) und eine Mikrosatelliteninstabilität im Tumor feststellen.
- Das Ärzteteam sollte frühzeitig auf BRCA-Keimbahn-Mutationen testen, wenn Betroffene für eine Platin-haltige Chemotherapie grundsätzlich infrage kommen. Liegt eine BRCA-Keimbahn-Mutation vor (in etwa 4 bis 7 Prozent der Fälle), wird eine entsprechend adaptierte Therapie empfohlen.
Weitere sinnvolle Tests und Therapieansätze
Nicht in der S3-Leitlinie empfohlen, aber unter bestimmten Bedingungen sinnvoll, kann die Bestimmung somatischer Genveränderungen sein:
BRCA-ness: Dieser Begriff steht für das Vorliegen einer HRD (homologe Rekombinationsreparaturdefizienz = Genveränderungen, die auf einen Defekt in der DNA-Reparatur hinweisen). Zu dieser Gruppe gehören auch Betroffene mit einer somatischen BRCA-Mutation im Tumorgewebe – neben denen mit einer Keimbahn-Mutation. Unabhängig vom KRAS-Status ist bei den insgesamt 15 bis 20 Prozent entsprechenden Tumoren zu erwarten, dass PARP-Hemmer wie Olaparib und eine Platin-haltige Chemotherapie besser wirken.
KRAS-Wildtyp: Hier sind Fachleute sich weitgehend einig darüber, Betroffenen ein sogenanntes Gen-Panel anzubieten. In Gen-Panels werden mittels Next-Generation-Sequencing (NGS) mehrere für eine Krebsart therapeutisch relevante Gene gleichzeitig überprüft. Für Fusionen des neurotrophen Tyrosin-Kinase-Rezeptors (NTRK) bereits zugelassen sind die Hemmstoffe Larotrectinib und Entrectinib.
In Studien oder als Off-Label-Use können folgende Substanzen infrage kommen:
- Crizotinib oder Loratinib bei ROS1-Fusionen
- Zenocutuzumab, ein bispezifischer HER2/HER3-Antikörper, bei NRG1-Fusionen
- Vemurafenib oder Dabrafenib bei BRAF-Mutationen
KRAS-Mutation: Bei KRAS-mutierten Tumoren unterscheidet man verschiedene Untertypen. Folgende zielgerichtete Wirkstoffe stehen (bisher nur in Studien) zur Verfügung:
- Sotorasib bei KRAS-G12C-Mutation
- Adagrasib bei KRAS-G12C-Mutation (derzeit nur außerhalb Deutschlands)
Fazit
Pankreaskarzinome sind genetisch heterogene Tumoren. Zunehmend gelingt eine molekulare Stratifizierung, die eine gezielte Therapiewahl anhand von Mutationen, Fusionen und anderen Genveränderungen ermöglicht. Ob die neuen Ansätze und ihre präzisionsonkologische Behandlung tatsächlich erfüllen, was sie versprechen, muss meist noch durch Studiendaten belegt werden.
Daher wenden Ärztinnen und Ärzte die molekulare Diagnostik und die darauf basierende zielgerichtete Therapie bevorzugt in klinischen Studien an. Einige universitäre Zentren testen Biomarker nach einem Stufenschema bereits bei allen Patienten und Patientinnen mit fortgeschrittenem Bauchspeicheldrüsenkrebs. Die Hoffnung ist, künftig evidenzbasierte Algorithmen zu entwickeln – für die Mehrheit der Betroffenen.
Zum Weiterlesen: Verwendete Quellen und vertiefende Informationen
Leitlinien und systematische Übersichtsarbeiten
Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S3-Leitlinie Exokrines Pankreaskarzinom, Langversion 2.0, 2021, AWMF Registernummer: 032-010OL (Stand 12/2021, aufgerufen am 27.07.2022).
Weitere Übersichtsarbeiten und Fachveröffentlichungen
Connor AA, Gallinger S. Pancreatic cancer evolution and heterogeneity: integrating omics and clinical data. Nat Rev Cancer. 2022 Mar;22(3):131-142. doi: 10.1038/s41568-021-00418-1.
Umemoto K, Yamamoto H, Oikawa R, Takeda H, Doi A, Horie Y, Arai H, Ogura T, Mizukami T, Izawa N et al. The molecular landscape of pancreatobiliary cancers for novel targeted therapies from real-world genomic profiling. J Natl Cancer Inst. 2022 May 18:djac106. doi: 10.1093/jnci/djac106.
Froeling FEM, Casolino R, Pea A, Biankin AV, Chang DK. Molecular Subtyping and Precision Medicine for Pancreatic Cancer. J Clin Med. 2021 Jan 4;10(1):149. doi: 10.3390/jcm10010149.
Pishvaian MJ, Blais EM, Brody JR, Lyons E, DeArbeloa P, Hendifar A, Mikhail S, Chung V, Sahai V, Sohal DPS et al. Overall survival in patients with pancreatic cancer receiving matched therapies following molecular profiling: a retrospective analysis of the Know Your Tumor registry trial. Lancet Oncol. 2020 Apr;21(4):508-518. doi: 10.1016/S1470-2045(20)30074-7. Epub 2020 Mar 2. Erratum in: Lancet Oncol. 2020 Apr;21(4):e182.
Qian Y, Gong Y, Fan Z, Luo G, Huang Q, Deng S, Cheng H, Jin K, Ni Q, Yu X et al. Molecular alterations and targeted therapy in pancreatic ductal adenocarcinoma. J Hematol Oncol. 2020 Oct 2;13(1):130. doi: 10.1186/s13045-020-00958-3.
Heinemann V, Boeck S, Westphalen CB. Therapie des metastasierten Pankreaskarzinoms. Inn Med. 2022; 63: 851–862. doi: 10.1007/s00108-022-01334-8.
Weitere Quellen (Auswahl)
1Qin S, Bai Y, Wang Z, Chen Z, Xu R, Xu J, Zhang H, Chen J, Yuan Y, Liu T et al. Nimotuzumab combined with gemcitabine versus gemcitabine in K-RAS wild-type locally advanced or metastatic pancreatic cancer: A prospective, randomized controlled, double-blinded, multicenter, and phase III clinical trial. Abstract LBA4011. Presented at the ASCO Annual Meeting 2022 (Chicago, IL, USA).
Strickler JH et al. First data for sotorasib in patients with pancreatic cancer with KRAS p.G12C mutation: A phase I/II study evaluating efficacy and safety. Abstract 360490. Presented at the American Society of Clinical Oncology (ASCO) Plenary Series in February 2022.
Session Debatte Pankreaskarzinom: Molekulare Diagnostik pro und contra, DGHO-Jahrestagung 2021, 1. - 4.10.2021, zusammengefasst in DGHO-Nachrichten vom 8.10.2021 (Springer Medizin), verfasst von Dr. Nicola Zink: Debatte zur Präzisionsonkologie. Pankreaskarzinom: Wie viel Molekulardiagnostik ist angemessen?