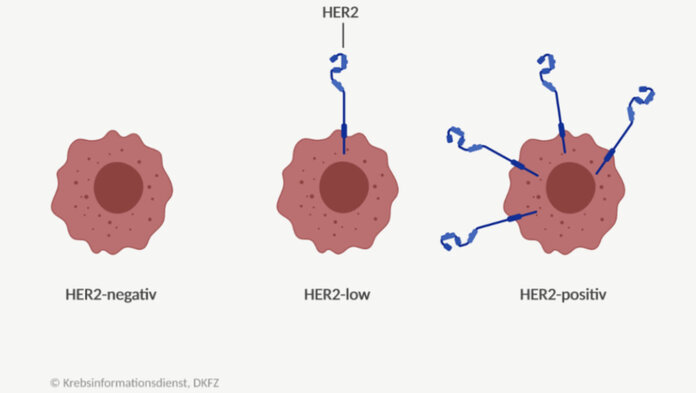
HER2-low: Definition
Der HER2-Status wird standardmäßig histopathologisch bestimmt. Als HER2-positiv gelten dabei zum einen Tumoren mit einem per Immunhistochemie (IHC) bestimmten Expressionslevel von 3+ und zum anderen Tumoren mit einem uneindeutigen Wert von 2+, wenn durch eine zusätzliche In-situ-Hybridisierung (ISH) eine Genvervielfältigung gezeigt wird (IHC 2+/ISH positiv).
Jetzt neu: Nun können Tumoren mit einem HER2-Expressionslevel von 1+ oder 2+/ISH negativ im Hinblick auf die neue Therapie mit T-DXd als HER2-low-Tumoren eingeordnet werden. HER2 0 gilt derzeit auch im Zusammenhang mit einer T-DXd-Therapie als negativ.
HER2-low-Brustkrebs: neue Option T-DXd
Die konventionellen gegen HER2 gerichteten Therapien wirken nur bei Patientinnen mit einem HER2-Expressionslevel von 3+ oder 2+/ISH positiv ausreichend gut. Das gilt beispielsweise für Trastuzumab und Pertuzumab sowie für das Antikörper-Wirkstoff-Konjugat (ADC) Trastuzumab Emtansin (T-DM1). Zu ADCs siehe auch Infokasten.
Zulassungserweiterung: Das neue ADC Trastuzumab-Deruxtecan (T-DXd, Handelsname Enhertu®) hat in der DESTINY-Breast04-Studie nun aber auch bei Patientinnen mit HER2-low-Brustkrebs in der fortgeschrittenen Erkrankungssituation eine Wirkung gezeigt. Seine Zulassung wurde entsprechend angepasst.
Warum wirkt T-DXd auch bei HER2-low?
Antikörper-Wirkstoff-Konjugate
Sogenannte konjugierte Antikörper oder Antikörper-Wirkstoff-Konjugate (englisch antibody drug conjugates, kurz ADCs) sind Antikörper, an die ein Zytostatikum geknüpft ist. Durch die Bindung des Antikörpers an sein Antigen, zum Beispiel HER2, kann der Wirkstoff gezielt in Tumoren angereichert werden, die dieses Antigen tragen.
Trastuzumab-Deruxtecan als ADC der 3. Generation ist stark mit einem hochwirksamen Zytostatikum beladen, welches zudem sehr gut freigesetzt werden kann. Auch in Tumoren, die nur geringe Mengen an HER2 tragen, kann dieses ADC sich offenbar ausreichend anreichern und als lokale Chemotherapie wirken.
Der Unterschied: Trastuzumab, Pertuzumab, aber auch Kinasehemmer wie Tucatinib wirken hauptsächlich dadurch, dass sie die Weitergabe wichtiger Teilungs- und Überlebensssignale durch HER2 unterbrechen. Sie wirken nicht, wenn die Krebszellen von diesen Signalen unabhängig sind. T-DM1 ist zwar ein (frühes) ADC und kann damit auch als Chemotherapie wirken, setzt aber deutlich weniger (und weniger wirksames) Zytostatikum frei als T-DXd. Darum reichert es sich nur in HER2-positiven, also HER2-überexprimierenden, Tumoren ausreichend an.
T-DXd: Cave Nebenwirkungen
Ein Punkt, der beim Einsatz von hochwirksamen Medikamenten gegen ein körpereigenes Antigen wie HER2 berücksichtigt werden muss: Ein solches Medikament kann sich auch gegen andere Körperzellen richten, die geringe Mengen des Antigens tragen. Geringe Mengen HER2 werden laut Human Protein Atlas unter anderem auch in der Lunge, in Muskeln einschließlich Herzmuskel oder Haut gebildet.
Beispiel: Eine der beschriebenen Nebenwirkungen von T-DXd ist das Auftreten von interstitiellen Lungenerkrankungen (ILD)/Pneumonitis. Hierauf muss unter der Behandlung geachtet werden.
HER2-low-Brustkrebs: (k)ein eigener Subtyp?
Die bisherigen Daten deuten insgesamt darauf hin, dass HER2-low kein eigener Brustkrebs-Subtyp ist. Biologisch ähneln HER2-low-Tumoren eher Tumoren ohne HER2-Expression als den HER2-positiven Tumoren. Nach der heute üblichen Einteilung der Brustkrebs-Subtypen nach Sørlie und Perou werden sie nach ihrem Genexpressionsmuster entweder den „typischen" triple-negativen (basalartigen) oder den Hormonrezeptor-positiven, HER2-negativen Tumoren zugeordnet. Bisher wurden auch im Ansprechen auf andere Therapiemodalitäten keine deutlichen Unterschiede beobachtet.
Was bedeutet das für die Therapie?
Derzeit ist die Konsequenz aus der Zulassungserweiterung für T-DXd "nur" eine neue Therapieoption für Patientinnen und Patienten mit geringer HER2-Expression. Die zur Behandlung von triple-negativem oder Hormonrezeptor-positivem Brustkrebs zugelassenen Medikamente können für die entsprechenden Tumoren selbstverständlich nach wie vor eingesetzt werden. Die Studien zur Wirksamkeit von Medikamenten bei "klassisch" HER2-negativen oder Hormonrezeptor-positiven Tumoren haben jeweils auch die HER2-low-Erkrankungen mit eingeschlossen.
Wann einsetzen: Laut Zulassung einsetzbar ist T-DXd derzeit, wenn Betroffene bereits in der metastasierten Erkrankungssituation eine Chemotherapie erhalten oder innerhalb von 6 Monaten nach Abschluss einer adjuvanten Chemotherapie einen Rückfall haben. Das bedeutet für Patientinnen mit Hormonrezeptor-positivem Brustkrebs, dass in aller Regel die antihormonellen beziehungsweise endokrin-basierten Behandlungsmöglichkeiten ausgeschöpft sind.
Offene Fragen
Ob sich die Wirksamkeit weiterer Medikamente zwischen HER2-low-Brustkrebs und vollständig HER2-negativem Brustkrebs unterscheidet, muss noch genauer untersucht werden. Weitere Punkte, an denen geforscht wird:
- Behandlung von anderen Krebsarten mit geringer HER2-Expression (zum Beispiel Darmkrebs, Urothelkarzinome)
- Behandlung von Betroffenen mit extrem geringer HER2-Expression (HER2-ultralow)
- Nutzen und Schaden eines Einsatzes von T-DXd schon in der frühen Erkrankungssituation
- optimale Reihenfolge der zur Verfügung stehenden Therapien
- (weitere) Standardisierung der Einstufung als HER2-low
- genauer Wirkmechanismus und mögliche Resistenzmechanismen
Fazit für die Praxis
Bei ursprünglich als HER2-negativ eingestuften Patientinnen mit metastasiertem Brustkrebs kann es hilfreich sein, bei unter oder kurz nach einer Chemotherapie fortschreitender Erkrankung den HER2-Status genau zu bestimmen. Dann können Patientinnen mit einem HER2-low-Mammakarzinom gegebenenfalls Trastuzumab-Deruxtecan anstelle einer weiteren Chemotherapie erhalten.
Unter der Behandlung muss allerdings insbesondere auf Symptome geachtet werden, die auf eine Pneumonitis/ILD hindeuten. In früheren Erkrankungssituationen wird T-DXd noch in Studien untersucht.
Wie der HER2-low-Brustkrebs in Leitlinien und Empfehlungen von Fachgesellschaften verankert werden wird, bleibt abzuwarten.
Zum Weiterlesen: Verwendete Quellen und vertiefende Informationen
Weitere Übersichtsarbeiten und Fachveröffentlichungen
Denkert C, Seither F, Schneeweiss A, Link T, Blohmer JU, Just M, Wimberger P, Forberger A, Tesch H, Jackisch C et al. Clinical and molecular characteristics of HER2-low-positive breast cancer: pooled analysis of individual patient data from four prospective, neoadjuvant clinical trials. Lancet Oncol. 2021 Aug;22(8):1151-1161. doi: 10.1016/S1470-2045(21)00301-6.
Giugliano F, Curigliano G, Tarantino P. HER2-low expression in breast oncology: treatment implications in the smart chemotherapy era. Eur J Cancer Prev. 2023 Mar 1;32(2):149-154. doi: 10.1097/CEJ.0000000000000781.
Li JJ, Yu Y, Ge J. HER2-low-positive and response to NACT and prognosis in HER2-negative non-metastatic BC. Breast Cancer. 2023 Jan 19. doi: 10.1007/s12282-022-01431-4.
Molinelli C, Jacobs F, Marchiò C, Pitto F, Cosso M, Spinaci S, de Azambuja E, Schettini F, Agostinetto E, Lambertini M. HER2-Low Breast Cancer: Where Are We? Breast Care (Basel). 2022 Dec;17(6):533-545. doi: 10.1159/000527391.
Schlam I, Tolaney SM, Tarantino P. How I treat HER2-low advanced breast cancer. Breast. 2023 Jan 12:S0960-9776(23)00005-X. doi: 10.1016/j.breast.2023.01.005.
Sode M, Thagaard J, Eriksen JO, Laenkholm AV. Digital image analysis and assisted reading of the HER2 score display reduced concordance - Pitfalls in the categorization of HER2-low breast cancer. Histopathology. 2023 Feb 3. doi: 10.1111/his.14877.
Perou CM, Sørlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, Pollack JR, Ross DT, Johnsen H, Akslen LA et al. Molecular portraits of human breast tumours. Nature. 2000 Aug 17;406(6797):747-52. doi: 10.1038/35021093.
Peiffer DS, Zhao F, Chen N, Hahn OM, Nanda R, Olopade OI et al. Clinicopathologic Characteristics and Prognosis of ERBB2-Low Breast Cancer Among Patients in the National Cancer Database. JAMA Oncol. 2023 Feb 23:e227476. doi: 10.1001/jamaoncol.2022.7476. Epub ahead of print.
Venetis K, Crimini E, Sajjadi E, Corti C, Guerini-Rocco E, Viale G, Curigliano G, Criscitiello C, Fusco N. HER2 Low, Ultra-low, and Novel Complementary Biomarkers: Expanding the Spectrum of HER2 Positivity in Breast Cancer. Front Mol Biosci. 2022 Mar 15;9:834651. doi: 10.3389/fmolb.2022.834651.
Xu B, Shen J, Shen J, Wang L. Prognostic impact of HER2-low expression in HER2-negative breast cancer under different hormone receptor status. Int J Clin Oncol. 2023 Feb 1. doi: 10.1007/s10147-023-02303-3.