Hirntumoren: Die WHO-Klassifikation 2021
Die im Dezember 2021 erschienene Neuauflage der WHO-Klassifikation von Tumoren des zentralen Nervensystems nimmt die Erkenntnisse zu Biologie und Prognose von primären Hirntumoren aus den letzten Jahren auf. Die Rolle der molekularen Diagnostik für die Einteilung der Hirntumoren ist weiter gestärkt. Unter Berücksichtigung von Klinik, Histologie und Molekulargenetik führen jetzt für jeden Tumortyp klar abgestufte Diagnosekriterien zu einer integrierten Tumordiagnose.
Integrierte Gliomdiagnosen 2021
Diffuse Gliome vom Erwachsenen-Typ
- IDH-mutiertes 1p/19q-kodeletiertes Oligodendrogliom
- IDH-mutiertes Astrozytom
- IDH-Wildtyp Glioblastom
Hochgradige Gliome vom pädiatrischen Typ (Auswahl)
- H3 K27-verändertes diffuses Mittellinien-Gliom
- H3 G34-mutiertes diffuses Hemisphären-Gliom
Niedriggradige Gliome vom pädiatrischen Typ (Auswahl)
- MYB- or MYBL1-verändertes diffuses Astrozytom
- MAPK-Signalweg-verändertes low-grade Gliom
Umschriebene astrozytäre Gliome (Auswahl)
- Pilozytisches Astrozytom
- Pleomorphes Xanthoastrozytom
Diagnose Gliom: Update für Astrozytom, Glioblastom und Co.
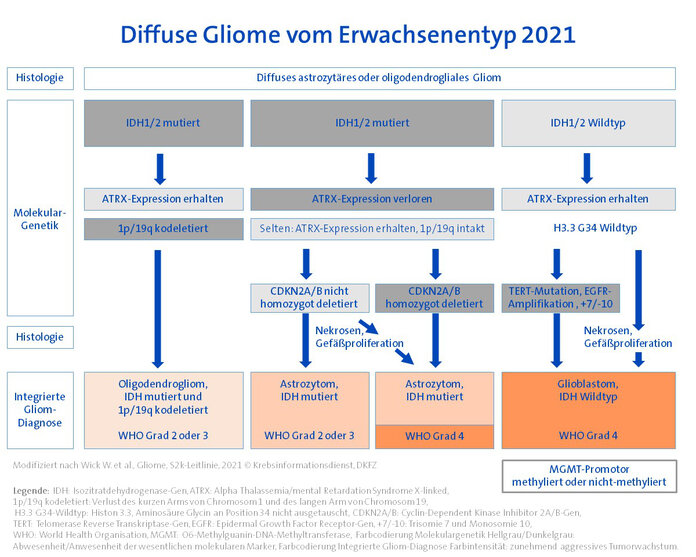
Bild: © Krebsinformationsdienst, Deutsches Krebsforschungszentrum
Die bei Erwachsenen mit Abstand am häufigsten vorkommenden Gliome sind Glioblastome und Astrozytome. Sie gehören zu den "Diffusen Gliomen vom Erwachsenen-Typ". Gliome vom "pädiatrischen Typ" kommen im Erwachsensenalter ebenfalls vor, sind hier jedoch selten. Allen Gliomen vom Erwachsenen- und vom pädiatrischen Typ ist gemeinsam, dass sie "diffus" ins umliegende Hirngewebe einwachsen. Eine vereinfachte Übersicht der Diagnosefindung bei diffusen Gliomen von Erwachsenentyp zeigt die Abbildung. Die wesentlichen Aspekte der Diagnostik und Einteilung werden in den folgenden Abschnitten erläutert.
IDH-Status erster Diagnostikschritt: Für diffuse Gliome vom Erwachsenen-Typ steht die Analyse des IDH-Gens (IDH: Isozitratdehydrogenase) an erster Stelle der molekularen Diagnostik. Diffuse astrozytäre und oligodendrogliale Tumoren werden in IDH-mutierte und IDH-nicht-mutierte (= IDH-Wildtyp) Gliome unterteilt. Glioblastome sind nach der neuen WHO-Klassifikation immer IDH-Wildtyp-Gliome. Die bisherige Diagnose "IDH-mutiertes Glioblastom" gibt es folglich nicht mehr.
ATRX-Expression und 1p/19q-Deletion: Unter den IDH-mutierten Gliomen ist die Bestimmung einer ATRX-Expression (ATRX: Alpha Thalassemia/mental Retardation Syndrome X-linked) im Zellkern der untersuchten Tumorzellen wegweisend: Lässt sich eine Expression nachweisen und zeigt sich darüber hinaus ein Verlust der Chromosomenstücke 1p/19q, führt das zur Diagnose eines IDH-mutierten, 1p/19q-deletierten Oligodendroglioms. Lässt sich eine ATRX-Expression nicht nachweisen (nuklärer ATRX-Verlust), liegt ein IDH-mutiertes Astrozytom vor.
Feinjustierung durch WHO-Grad: Der WHO-Grad ist bei Gliomen traditionell ein Maß dafür, wie aggressiv der Hirntumor wächst. Als Zeichen für ein aggressives Wachstum gelten Nekrosen und Gefäßproliferationen in der Histologie. Der WHO-Grad definierte lange Zeit unterschiedliche Gliomtypen, so beispielsweise diffuse Astrozytome WHO-Grad II und anaplastische Astrozytome WHO-Grad III. Ab sofort gilt für den WHO-Grad:
- Um Fehlern vorzubeugen, wird der WHO-Grad mit arabischen Ziffern und nicht mehr, wie früher üblich, mit römischen Ziffern angegeben.
- Der WHO-Grad unterscheidet Untergruppen innerhalb der IDH-mutierten Oligodendrogliome und Astrozytome: Je nach Histologie wird ein WHO-Grad 2 oder 3 vergeben. Die Bezeichnungen "diffus" und "anaplastisch" in der Gliomdiagnose fallen weg.
- Molekulare Marker bestimmen den WHO-Grad bei IDH-mutierten Astrozytomen mit: Unabhängig von einer entsprechenden Histologie können jetzt auch spezifische Veränderungen im CDKN2A/B-Gen die Zuordnung zum WHO-Grad 4 auslösen.
- Diffuse Astrozytome vom IDH-Wildtyp gelten generell als Gliome WHO-Grad 4.
Glioblastome jetzt auch molekular definiert: Das häufigste Gliom bei Erwachsenen ist das Glioblastom. Diese Tumoren entsprechen diffusen astrozytären Gliomen ohne IDH-Mutation, aber mit histologischen Merkmalen einer pathologischen Gefäßproliferation und/oder Nekrosen. Zusätzlich werden IDH-Wildtyp-Gliome jetzt auch ohne entsprechend aggressive Histologie als Glioblastom eingestuft, wenn eine oder mehrere der folgenden molekularen Marker vorliegen:
- Amplifikation des epidermalen Wachstumsfaktorrezeptor-Gens (EGFR),
- Promotormutationen des Telomerase-Reverse-Transkriptase (TERT)-Gens und/oder
- ein Gewinn von Chromosom 7, kombiniert mit einem Verlust des Chromosoms 10 (+7/–10).
Histon-Modifikation definiert neue Gliomarten
Histone sind Eiweiße, die in der Zelle für die "Verpackung" beziehungsweise die äußere Struktur der Erbinformation (DNA) mitverantwortlich sind. Veränderungen in einzelnen Histonen definieren zwei neue Tumortypen bei den IDH-Wildtyp-Gliomen:
- das Histon-3 K27M-veränderte diffuse Mittellinien-Gliom
- das Histon-3.3 G34-mutierte diffuse hemisphärische Gliom
Diese Tumoren wurden früher vermutlich vorwiegend als Glioblastom diagnostiziert. Sie kommen vor allem bei Kindern, Jugendlichen und jungen Erwachsenen vor.
DNA-Methylierungsanalyse hilft bei Unklarkeiten
Die DNA-Methylierung ist ein Prozess, der die Genaktivität beeinflusst. Mit diesem Begriff bezeichnen Fachleute das Anhängen von Methylgruppen (Summenformel -CH3) an die Bausteine der DNA. Bei einer starken Methylierung (Hypermethylierung) werden betroffene Gene abgeschaltet. Umgekehrt sind Gene sehr aktiv, wenn sie wenig methyliert (hypomethyliert) sind. Das DNA-Methylierungsmuster ist charakteristisch für die spezifische Genaktivität in den untersuchten Zellen.
Der DNA-Methylom-Classifier: Bei der Charakterisierung von Tumor-DNA-Methylierungsprofilen wird das Methylierungsmuster des untersuchten Hirntumors mit Methylierungsmustern verglichen, die zuvor aus vielen verschiedenen Tumorpräparaten für einzelne Hirntumortypen erstellt wurden. Der Methylierungs-Classifier verbessert in einzelnen Fällen die diagnostische Zuordnung eines Hirntumors zu einem speziellen Gliom-Untertyp.
Integrierte Gliomdiagnose nicht immer möglich
Nicht immer kann bei der Untersuchung eines Hirntumors eine integrierte histomolekulare Diagnose gestellt werden.
NOS-Diagnose: Manchmal kann beispielsweise nicht genügend Tumorgewebe untersucht werden, die entsprechenden molekularen Testverfahren sind nicht verfügbar oder die DNA in den untersuchten Tumorzellen ist qualitativ nicht geeignet (degradiert). Dann wird der Tumor histologisch beschrieben und erhält den Zusatz NOS für "not otherwise specified".
NEC-Diagnose: Sind bei einem Hirntumor alle molekularen Untersuchungen ordnungsgemäß erfolgt und kann dennoch keine WHO-Diagnose gestellt werden, wird der Zusatz NEC für "not elsewhere classified" vergeben. Dies kann zum Beispiel bei neuen Tumortypen der Fall sein, die bislang noch nicht in der WHO-Klassifikation berücksichtigt sind.
Fazit und Ausblick
Noch liegen nicht für alle neu definierten Gliomtypen ausreichend Studiendaten vor, um evidenzbasierte Therapieentscheidungen zu treffen. Daher ist wichtig:
- Die neuen molekulardiagnostischen Algorithmen zur Klassifikation von Gliomen müssen rasch zum Standard werden. So können für die Zukunft weitere Erkenntnisse gewonnen und spezifische Therapien etabliert werden.
- Experimentelle Behandlungsverfahren sollten bei Gliomen weiterhin bevorzugt in klinischen Studien eingesetzt werden – sowohl in der Primärtherapie als auch in der Rezidivsituation.
In der S2k-Leitlinie Gliome 2021 der Deutschen Gesellschaft für Neurologie (DGN) wird die neue WHO-Klassifikation für Hirntumoren bereits berücksichtigt. Und aktuelle Studienkonzepte für Gliome haben die integrierten Gliomdiagnosen ebenfalls schon im Blick.
Zum Weiterlesen: Verwendete Quellen und vertiefende Informationen
WHO Classification of Tumours Editorial Board. Central Nervous System Tumours. Lyon (France): International Agency for Reasearch on Cancer; 2021. (WHO classification of tumours series, 5th ed.; vol. 6). https://publications.iarc.fr/601.
Leitlinien und systematische Übersichtsarbeiten
* S2k-Leitlinie Gliome 2021: Wick W. et al., Gliome, S2k-Leitlinie, 2021, in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. Online: www.dgn.org/leitlinien (abgerufen am 21.01.2022).
EANO Guideline 2021: Weller M, van den Bent M, Preusser M, Le Rhun E, Tonn JC, Minniti G, Bendszus M, Balana C, Chinot O, Dirven L et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol 2021; 18: 170–186. doi: 10.1038/s41571-020-00447-zs. https://www.nature.com/articles/s41571-020-00447-z.
DGHO-Leitlinie Gliome im Erwachsenenalter 2021: Hofer S, Bullinger L, Dierlamm J, Grosu AL, Hau P, Hense J, Hoffmann J, Proescholdt M, Pflugshaupt T, Preusser M et al. https://www.onkopedia.com/de/onkopedia/guidelines/gliome-im-erwachsenenalter/@@guideline/html/index.html.
cIMPACTNOW 6: Louis DN, Wesseling P, Aldape K, Brat DJ, Capper D, Cree IA, Eberhart C, Figarella-Branger D, Fouladi M, Fuller GN et al. cIMPACT-NOW update 6: new entity and diagnostic principle recommendations of the cIMPACT-Utrecht meeting on future CNS tumor classification and grading. Brain Pathol. 2020 Jul;30(4):844-856. doi: 10.1111/bpa.12832.
Weitere Übersichtsarbeiten und Fachveröffentlichungen
Gonzalez Castro LN, Wesseling P. The cIMPACT-NOW updates and their significance to current neuro-oncology practice. Neuro-Oncology Practice 2021; 8(1): 4–10. doi: 10.1093/nop/npaa055.
Gritsch S, Batchelor TT, Gonzalez Castro LN. Diagnostic, therapeutic, and prognostic implications of the 2021 World Health Organization classification of tumors of the central nervous system. Cancer 2021;0:1-12. doi: 10.1002/cncr.33918.
Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Brange D, Hawkins C, Ng HK., Pfister SM, Reifenberger G et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro-Oncology 2021; 23(8): 1231–1251. doi:10.1093/neuonc/noab106.
Wen PY and Packer RJ. The 2021 WHO Classification of Tumors of the Central Nervous System: clinical implications. Neuro-Oncology 2021: 23(8): 1215–1217. doi:10.1093/neuonc/noab120.
