"Don't eat me" – das CD47-Signal
Natürliche Fresszellen wie Makrophagen erkennen defekte oder bösartig veränderte Zellen über Strukturen auf deren Zelloberfläche, sogenannte "Eat-me"-Signale. Die Fresszellen verleiben sich die gestörten Zellen dann durch Phagozytose ein und machen sie unschädlich. In einem zweiten Schritt präsentieren Makrophagen gegebenenfalls einzelne Tumor-Antigene und aktivieren so auch gezielt das spezifische Immunsystem.
Viele Tumorzellen stellen auf ihrer Zelloberfläche verstärkt "Don't eat me"-Signale bereit, die Makrophagen an ihrer Arbeit hindern. Ein solches "Friss-mich-nicht"-Signal ist das Protein CD47. Bindet CD47 an den Makrophagen-Rezeptor SIRPα (Signal Regulatory Protein Alpha), wird die Phagozytosefähigkeit der Fresszelle gebremst. Die Tumorzellen bleiben verschont.
"Just eat me" – die Bremse lösen
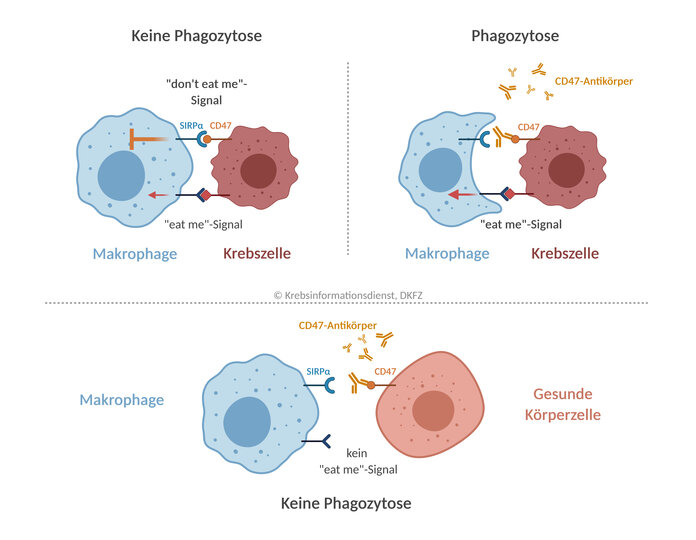
Bild: Krebsinformationsdienst, DKFZ, erstellt mit BioRender.com
Hemmstoffe gegen CD47/SIRPα verhindern, dass CD47 an SIRPα bindet. Dadurch wird die "Bremse" in den Makrophagen gelöst. Da auf einer Tumorzelle als veränderter Körperzelle in der Regel gleichzeitig "Eat-me"-Signale vorhanden sind, können die Fresszellen die Phagozytose einleiten und die Krebszelle vernichten.
Gesunde Zellen sind geschützt: Auch Körperzellen tragen meist CD47 auf ihrer Zelloberfläche. Sie brauchen das Signal aber normalerweise nicht, um sich vor Makrophagen zu schützen, denn: Sind die Zellen intakt, fehlt ihnen ein "Eat-me"-Signal. Eine CD47-Antikörpertherapie bleibt hier folgenlos.
Ältere oder defekte Körperzellen sind gefährdet: Tragen sie in gewissem Umfang "Friss-mich"-Signale, können diese Zellen unter der Therapie mit CD47-Antikörpern rascher "entsorgt" werden. Von Bedeutung ist dies vor allem für ältere, aber noch funktionsfähige roten Blutzellen. Unter der Behandlung kann es zu einer relevanten Blutarmut kommen.
Präklinische Grundlagenforschung
Beschrieben wurde das Protein CD47 bereits vor über 30 Jahren als "Integrin-assoziiertes Protein" in Leukozyten. Experimente der Grundlagenforschung zeigten, dass CD47 sowohl bei hämatologischen Tumoren als auch bei soliden Tumoren stark exprimiert wird. Dies führt zu einer verminderten Phagozytose durch Makrophagen. Klinisch kann dies mit aggressiveren Erkrankungsverläufen verbunden sein. Inzwischen ist CD47/SIRPα als universelles Signal anerkannt, das Krebszellen nutzen, um dem unspezifischen Immunsystem zu entgehen.
Labor- und Tierversuche: Alles in allem bot die präklinische Forschung eine gute Grundlage, Medikamente zu entwickeln, die diesen Mechanismus hemmen. Krebsforscher konstruierten CD47-Antikörper und weitere Hemmstoffe des CD47/SIRPα-Signals und untersuchten diese in Labor- und Tierversuchen. Erste Studien waren erfolgversprechend. Sie zeigten zudem, dass durch die verstärkte Aktivität der Makrophagen auch das spezifische Immunsystem stimuliert wird.
Erste "First-in-Man"-Studien bei Krebs
Inzwischen gibt es auch erste klinische Daten bei Krebspatienten, hauptsächlich bei verschiedenen Blutkrebserkrankungen.
Als Monotherapie wenig wirksam: Erfahrungen mit dem "First-in-Man" CD47-Antikörper Magrolimab (Hu-5F9) bei Patienten mit akuter myeloischer Leukämie (AML), myelodysplastischem Syndrom (MDS) und soliden Tumoren waren zunächst enttäuschend1. Als Monotherapie war der Antikörper bei den Patienten nur wenig wirksam. Möglicherweise reichen die vorhandenen "Eat-me"-Signale auf den Krebszellen allein für eine effektive Immunantwort nicht aus.
In Kombination effektiver: In weiteren Studien wurde Magrolimab deshalb mit Medikamenten kombiniert. Sie sollen die "Eat-me"-Signale auf den Tumorzellen gezielt verstärken. Partner sind beispielsweise der CD20-Antikörper Rituximab bei Patienten mit Non-Hodgkin-Lymphom und die hypomethylierende Substanz Azacitidin bei Patienten mit AML/MDS. Damit zeigte sich eine deutlich bessere Effektivität. Erste Studienergebnisse sind im untenstehenden Infokasten zusammengefasst.
Nebenwirkungen: Der CD47-Antikörper wird laut der bislang vorliegenden Studiendaten von den Patienten insgesamt gut vertragen. Im Vordergrund der mild bis mäßig ausgeprägten Nebenwirkungen stehen eine Anämie und weitere Zytopenien, Kopfschmerzen, Fatigue, Fieber, Erkältungsbeschwerden, Infusionsreaktionen und Gelenkbeschwerden.
Zwischenergebnisse früher Studien bei Lymphomen und AML/MDS
Magrolimab und Rituximab bei Patienten mit mehrfach vorbehandeltem diffus großzelligen B-Zell-Lymphom (DLBCL) bzw. follikulärem Lymphom2: Bei der Hälfte der 22 Studienpatienten sprach das Lymphom längerfristig auf die Behandlung an.
Magrolimab und Azacitidin bei Patienten mit unbehandelter AML/MDS3: Bei knapp 2 von 3 Studienpatienten besserte sich die vorbestehende Transfusionsabhängigkeit. Für das MDS zeigte sich: Bei 30 von 33 Patienten sprach die Erkrankung auf die Kombinationstherapie an.
Der Blick in die Zukunft
CD47-Hemmstoffe könnten die Palette der Immun-Krebstherapie künftig bereichern. Bislang ist die Behandlung noch experimentell. Weltweit ist bislang kein entsprechendes Medikament zugelassen.
Magrolimab/Azacitidin-Studie bei MDS: Am weitesten fortgeschritten ist die klinische Entwicklung bei Patienten mit myelodysplastischem Syndrom (MDS). Im Herbst 2020 starteten Ärzte eine große Phase-III-Studie, in der der CD47-Antikörper Magrolimab mit Azacitidin kombiniert eingesetzt wird4. Ergebnisse dieser Studie werden mitentscheidend dafür sein, ob Magrolimab in näherer Zukunft als Medikament für Patienten mit MDS zugelassen und auch in weiteren Studien mit anderen Krebserkrankungen eingehender untersucht werden wird.
Weitere Substanzen: Neben Magrolimab werden weitere CD47-Antikörper in sehr frühen Studien untersucht. Auch Substanzen, die SIRPα blockieren, werden erforscht. Interessant für die Arzneimittelforschung sind auch sogenannte QPCTL-Enzym-Hemmer. Sie hemmen das Enzym "Glutaminyl-Peptide CycloTransferase-Like", das bei der Herstellung von CD47 wichtig ist.
Viele Fragen sind noch offen:
- Welche Krebspatienten profitieren besonders von den neuen Checkpoint-Hemmern? Die Wissenschaftler suchen nach Biomarkern, die einen Erfolg der Behandlung vorhersagen können.
- Welche Kombinationen sind hilfreich? Therapien, die als Partner das "Eat-me"-Signal verstärken, sind möglicherweise zielgerichtete Antikörper, aber auch Chemotherapien und eine Strahlentherapie. Auch PD-1/PD-L1-Checkpoint-Hemmer werden in klinischen Studien mit CD47/SIRPα-Hemmstoffen kombiniert.
- Wie können gesunde Zellen bestmöglich geschützt werden? Entscheidend sind Auswahl und Art der eingesetzten Hemmstoffe und ihrer Kombinationspartner. Eine Anämie könnte darüber hinaus mit dem sogenannten "Priming" vermindert werden: Geringe CD47-Antikörper-Dosen fangen ältere rote Blutzellen bereits vor der eigentlichen Behandlung gezielt ab.
Das Fazit: Mit CD47-Hemmern sind vielversprechende Checkpoint-Hemmer des unspezifischen Immunsystems für Krebspatienten in der Pipeline. Weitere umfassende präklinische und klinische Forschung ist aber notwendig, bevor CD47/SIRPα-Hemmstoffe in die Routineanwendung bei Krebs gelangen können.
Zum Weiterlesen: Verwendete Quellen und vertiefende Informationen
Übersichtsarbeiten und Fachveröffentlichungen
Chao MP, Takimoto CH, Feng DD, McKenna K, Gip P, Liu J, Volkmer JP, Weissman IL, Majeti R. Therapeutic Targeting of the Macrophage Immune Checkpoint CD47 in Myeloid Malignancies. Front Oncol. 2020 Jan 22;9:1380. doi: 10.3389/fonc.2019.01380.
Feng R, Zhao H, Xu J, Shen C. CD47: the next checkpoint target for cancer immunotherapy. Crit Rev Oncol Hematol. 2020 Aug;152:103014. doi: 10.1016/j.critrevonc.2020.103014.
Logtenberg MEW, Scheeren FA, Schumacher TN. The CD47-SIRPα Immune Checkpoint. Immunity. 2020 May 19;52(5):742-752. doi: 10.1016/j.immuni.2020.04.011.
Russ, A., Hua, AB, Montfort, WR, Rahman, B, Riaz, IB, Khalid, MU, Carew, JS, Nawrocki, ST, Persky, D, Anwer, F. Blocking "don't eat me" signal of CD47-SIRPα in hematological malignancies, an in-depth review. Blood reviews, 2018 Nov; 32(6), 480–489. doi: 10.1016/j.blre.2018.04.005.
1 Sikic BI, Lakhani N, Patnaik A, Shah SA, Chandana SR, Rasco D, Colevas AD, O'Rourke T, Narayanan S, Papadopoulos K et al. First-in-Human, First-in-Class Phase I Trial of the Anti-CD47 Antibody Hu5F9-G4 in Patients With Advanced Cancers. J Clin Oncol. 2019 Apr 20;37(12):946-953. doi: 10.1200/JCO.18.02018.
2 Advani R, Flinn I, Popplewell L, Forero A, Bartlett NL, Ghosh N, Kline J, Roschewski M, LaCasce A, Collins GP et al. CD47 Blockade by Hu5F9-G4 and Rituximab in Non-Hodgkin's Lymphoma. N Engl J Med. 2018 Nov 1;379(18):1711-1721. doi: 10.1056/NEJMoa1807315.
3 Sallman DA, Al Malki M, Asch AS, Junseung Lee D, Kambhampati S, Donnellan WB, Bradley TJ, Vyas P, Jeyakumar D, Marcucci G et al. Tolerability and efficacy of the first-in-class anti-CD47 antibody magrolimab combined with azacitidine in MDS and AML patients: Phase Ib results. Journal of Clinical Oncology 38, no. 15_suppl (May 20, 2020) 7507-7507. DOI: 10.1200/JCO.2020.38.15_suppl.7507.
Sonstiges
FDA Pressemitteilung vom 16.09.2020: "Gileads magrolimab grabs breakthrough-therapy-designation for myelodysplastic syndrome"
4 Phase-III-Studie "ENHANCE", NCT04313881: Magrolimab + Azacitidine Versus Azacitidine + Placebo in Untreated Participants With Myelodysplastic Syndrome (MDS).